-
下列各组原子中彼此化学性质一定相似的是( )
A. 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B. 原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C. 2p轨道上有一对成对电子的X原子和3p轨道上只有一对成对电子的Y原子
D. 最外层都只有一个电子的X、Y原子
难度: 困难查看答案及解析
-
下列关于原子核外电子排布与元素在周期表中位置关系的表述中,正确的是( )
A.基态原子的N层上只有一个电子的元素,一定是ⅠA族元素
B.原子的价电子排布为(n-1)d6~8ns2的元素一定是副族元素
C.基态原子的p能级上半充满的元素一定位于p区
D.基态原子的价电子排布为(n-1)dxny的元素的族序数一定为x+y
难度: 中等查看答案及解析
-
已知X、Y是主族元素,I为电离能,单位是kJ/mol。请根据下表数据判断,错误的是( )
元素
I1
I2
I3
I4
X
500
4600
6900
9500
Y
580
1800
2700
11600
A.元素X的常见化合价是+1价
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
难度: 中等查看答案及解析
-
不能说明X的电负性比Y的大的是( )
A. 与H2化合时X单质比Y单质容易
B. X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强
C. X原子的最外层电子数比Y原子的最外层电子数多
D. X单质可以把Y从其氢化物中置换出来
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是( )
A.X的简单氢化物的热稳定性比W强
B.Y的简单离子与X的具有相同的电子层结构
C.Y与Z形成化合物的水溶液可使蓝色石蕊试纸变红
D.Z与X属于同一主族,与Y属于同一周期
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.3p2表示3p能级上有2个电子
B.处于最低能量的原子叫做基态原子
C.同一原子中,3s、3p、3d、4s 能级的能量逐渐增大
D.同一原子中,3s、3p、3d能级的轨道数依次增多
难度: 中等查看答案及解析
-
下列各组元素中,第一电离能依次减小的是( )
A. H Li Na K B. Na Mg Al Si
C. I Br Cl F D. F O N C
难度: 中等查看答案及解析
-
下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C.最外层电子数是核外电子总数的
的原子和价电子排布为4s24p5的原子
D.2p能级有一个未成对电子的基态原子和价电子排布为2s22p5的原子
难度: 简单查看答案及解析
-
用R代表短周期元素,R原子最外层的p能级上的未成对电子只有2个。下列关于R的描述中正确的是
A.R的氧化物都能溶于水
B.R的最高价氧化物对应的水化物都是H2RO3
C.R都是非金属元素
D.R的氧化物都能与NaOH反应
难度: 中等查看答案及解析
-
下列关于价电子排布式为3s23p4的粒子的描述正确的是( )
A.它的原子核外有三种形状不同的电子云
B.它的原子核外电子共有16种不同的运动状态
C.它可与H2反应生成常温时的液态化合物
D.该原子的轨道表示式为
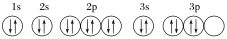
难度: 中等查看答案及解析
-
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
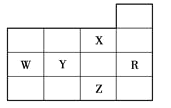
A.W元素的第一电离能小于Y元素的第一电离能
B.Y、Z的阴离子电子层结构都与R原子的相同
C.p能级未成对电子最多的是Z元素
D.X元素是电负性最大的元素
难度: 中等查看答案及解析
-
已知X、Y是短周期的两种元素,下列有关比较或说法中一定正确的是( )
选项
条件
结论
A
若原子半径:X>Y
原子序数:X<Y
B
化合物XnYm中X显负价
元素的电负性:X>Y
C
若价电子数:X>Y
最高正价:X>Y
D
若X、Y最外层电子数分别为1、7
X、Y之间一定能形成离子键
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列说法中不正确的是( )
A.双键、叁键都有π键
B.成键原子间原子轨道重叠越多,共价键越牢固
C.因每个原子未成对电子数是一定的,故配对原子个数也一定
D.所有原子轨道在空间都有自己的方向性
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.键能越小,表示化学键越牢固,难以断裂
B.两原子核越近,键长越长,化学键越牢固,性质越稳定
C.破坏化学键时,消耗能量,而形成新的化学键时,则释放能量
D.键能、键长只能定性地分析化学键的特性
难度: 简单查看答案及解析
-
下列有关化学键类型的叙述正确的是( )
A.全部由非金属构成的化合物中肯定不存在离子键
B.所有物质中都存在化学键
C.已知乙炔的结构式为H—C≡C—H,则乙炔中存在2个σ键(C—H)和3个π键(C≡C)
D.乙烷分子中只存在σ键,不存在π键
难度: 简单查看答案及解析
-
A+、B2+、C-、D2-4种离子具有相同的电子层结构。现有以下排列顺序:
①B2+>A+>C->D2-②C->D2->A+>B2+③B2+>A+>D2->C-④D2->C->A+>B2+4种离子的半径由大到小以及4种元素原子序数由大到小的顺序分别是( )
A.①④ B.④① C.②③ D.③②
难度: 简单查看答案及解析
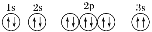 该同学所画的轨道表示式违背了________________。
该同学所画的轨道表示式违背了________________。