-
化学与生产和生活密切相关。下列过程中没有发生化学变化的是( )
A. 氯气作水杀菌消毒剂
B. 硅胶作袋装食品的干燥剂
C. 二氧化硫作纸浆的漂白剂
D. 肥皂水作蚊虫叮咬处的清洗剂
难度: 简单查看答案及解析
-
铜镁合金2.14 g完全溶于一定浓度的硝酸,硝酸被还原成NO2、NO、N2O三种气体且标准况下它们体积均为0.224 L。反应后的溶液中加入足量氢氧化钠溶液,生成的沉淀经过滤、洗涤、干燥后称量,质量为
A. 4.18 g B. 3.12 g C. 4.68 g D. 5.08 g
难度: 困难查看答案及解析
-
下列有关物质用途的叙述中,不正确的是( )
A.Cl2常用于自来水消毒 B.SO2常用于漂白食品
C.SiO2常用于制造光导纤维 D.Na2O2可用于呼吸面具中氧气的来源
难度: 简单查看答案及解析
-
我国清代《本草纲目拾遗》中记载药物“鼻冲水”,写道:“贮以玻璃瓶,紧塞其口,勿使泄气,则药力不减,气甚辛烈,触人脑,非有病不可嗅。……。虚弱者忌之。宜外用,勿服。……。”这里的“鼻冲水”是指( )
A.氨水 B.硝酸 C.醋 D.卤水
难度: 困难查看答案及解析
-
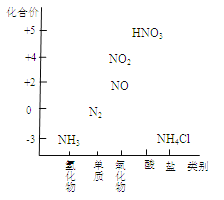
下列反应中,起了氮的固定作用的是
A.N2和H2在一定条件下合成氨 B.由氨制成碳酸氢铵或硫酸铵
C.NO和O2反应生成NO2 D.NO2与H2O反应生成HNO3
难度: 简单查看答案及解析
-
下列化学现象及解释错误的是
选项
现象
解释
A
Cl2在H2中点燃,瓶口有白雾
生成HCl极易溶于水
B
饱和Na2CO3溶液中通入CO2析出白色晶体
生成NaHCO3溶解度小析出
C
常温下将铝片放入浓硝酸中无明显变化
Al和浓硝酸不反应
D
SO2通入溴水,溴水褪色
SO2具有还原性。
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列关于硅单质及其化合物的说法正确的是( )
①硅是构成一些岩石和矿物的基本元素
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质是良好的半导体材料
④陶瓷是人类应用很早的硅酸盐材料
⑤水玻璃可用于生产黏合剂和防火剂
⑥二氧化硅是一种原子晶体,用作光纤以及电脑芯片
A.①②③④ B.②③⑤⑥ C.①③④⑤ D.②③④⑤
难度: 中等查看答案及解析
-
学生做如下实验:第一步,在淀粉KI溶液中,滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失。下列叙述中该同学对实验原理的解释和所得结论不正确的是( )
A.氧化性:ClO->I2>SO42-
B.蓝色消失的原因是Na2SO3溶液反应生成SO2具有漂白性
C.淀粉KI溶液变蓝是因为I-被ClO-氧化为I2,I2遇淀粉变蓝
D.若将Na2SO3溶液加入溴水,溴水褪色
难度: 中等查看答案及解析
-
已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
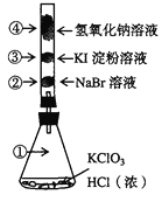
①
②
③
④
A
黄绿色
橙色
蓝色
白色
B
无色
橙色
紫色
白色
C
黄绿色
橙色
蓝色
无色
D
黄绿色
无色
紫色
白色
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
如图装置,将溶液A逐渐加入固体B中,下列叙述中不正确的是( )
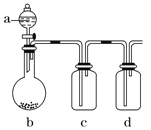
A.若a为浓硫酸,b为Na2SO3固体,c中盛石蕊溶液,则c中溶液先变红后褪色
B.若a为浓盐酸,b为MnO2,c中盛品红溶液,则c中溶液不褪色
C.若a为醋酸溶液,b为贝壳,c中盛过量澄清石灰水,则c中溶液变浑浊
D.若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀
难度: 中等查看答案及解析
-
下列各组气体,经充分反应后,原来的气体有剩余的是 ( )
A.1mol NH3和1mol HCl混合
B.1mol NO和0.5mol O2混合
C.1mol SO2和1mol H2S混合
D.等体积的NO和NO2被足量烧碱溶液吸收
难度: 中等查看答案及解析
-
要除去CO2中含有的少量的SO2杂质,可选用的一组试剂是( )
①NaOH溶液 ②NaHCO3溶液 ③Na2CO3溶液
④HNO3酸化的Ba(NO3)2溶液 ⑤氨水 ⑥酸性KMnO4溶液
A.②⑥ B.②③ C.②④⑥ D.②③⑥
难度: 简单查看答案及解析
-
2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德·埃特尔。他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法正确的是
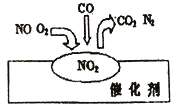
A.NO2是该过程的最终产物
B.NO 和O2必须在催化剂表面才能反应
C.汽车尾气的主要污染成分是CO2和NO
D.该催化转化的总反应方程式为:2NO+O2+4CO
4CO2+N2
难度: 中等查看答案及解析
-
下列制备和收集气体的实验装置合理的是
A.用氯化铵和氢氧化钙制氨气
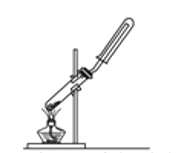
B.用铜片和稀硝酸制NO
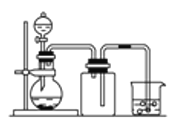
C.用锌粒和稀硫酸制氢气
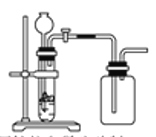
D.用双氧水和二氧化锰制氧气
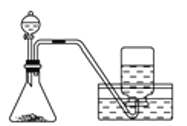
难度: 中等查看答案及解析
-
有一酸性溶液可能含有Br-、SO42-、H2SO3、NH4+ 等微粒,对该酸性溶液分别进行实验:
(1)加热,放出的气体可以使品红溶液褪色;
(2)取原溶液加碱,调至溶液呈碱性,加热,放出的气体能使湿润的红色石蕊试纸变蓝;
(3)取原溶液加氯水,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列微粒不能确认其在原溶液中是否存在的是
A.SO42- B.Br- C.H2SO3 D.NH4+
难度: 中等查看答案及解析
-
3.04g铜镁合金完全溶解于100mL 14.0mol/L的浓硝酸中,得到NO2和N2O4的混合气体2240mL(标准状况),向反应后的溶液中加入2.0mol/L NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2∶1
B.被还原的硝酸的物质的量是0.12mol
C.得到5.08g沉淀时,加入NaOH溶液的体积是700mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
难度: 困难查看答案及解析