-
用已知浓度盐酸滴定未知浓度的NaOH溶液会导致测得NaOH溶液浓度偏高的是 ( )
A.滴定前滴定管中有气泡,滴定后消失
B.碱式滴定管量取NaOH溶液时,未进行润洗操作
C.滴定时达到滴定终点时俯视读数
D.锥形瓶取用NaOH待测液前加少量水洗涤
难度: 简单查看答案及解析
-
在10mL0.1mol·L-1NaOH溶液中加入同体积、同浓度的CH3COOH溶液,反应后溶液中各微粒的浓度关系错误的是( )
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.c(Na+)=c(CH3COO-)+c(CH3COOH)
D.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
难度: 简单查看答案及解析
-
在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液:K+、Cl- 、Mg2+、
、
B.
=0.1mol/L的溶液:
、
、
、
C.Na2CO3溶液:K+、Fe3+、
、
D.能使pH试纸呈红色的溶液:Na+、
、I-、
难度: 中等查看答案及解析
-
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)
Z(g) ΔH<0,反应经60 s达到平衡并生成0.3 mol Z,则下列说法中正确的是( )
A. 其他条件不变,升高温度逆反应速率加快,正反应速率减慢
B. 其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的
C. 其他条件不变,将容器体积缩小至5 L,平衡正向移动,平衡常数增大
D. 以Y浓度变化表示的反应速率为0.000 5 mol·L-1·s-1
难度: 中等查看答案及解析
-
对于可逆反应:2SO2+O2
2SO3,△H<0下列措施能使反应物中活化分子百分数、化学平衡状态都发生变化的是( )
A.增大压强 B.升高温度 C.使用催化剂 D.多充O2
难度: 简单查看答案及解析
-
下列各溶液中,微粒的物质的量浓度关系正确的是
A.常温下,将pH=2的盐酸和pH=12的氨水等体积混合:c(NH4+)>c(Cl-)> c(OH-)>c(H+)
B.0.1mol·L-1Na2CO3溶液:c(Na+)=c(HCO3-)+2c(CO32-)+2c(H2CO3)
C.0.1mol·L-1NH4Cl溶液:c(NH4+)=c(Cl-)
D.向醋酸钠溶液加适量醋酸,得到的混合溶液:c(Na+)=c(CH3COO-)+c(OH-)
难度: 困难查看答案及解析
-
如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
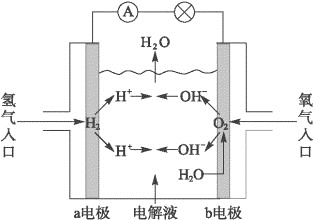
A.a电极是负极
B.b电极的电极反应为:4OH--4e-====2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
难度: 中等查看答案及解析
-
可逆反应aA(g)+bB(s)
cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
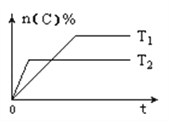
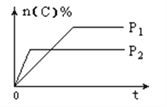
A.升高温度,平衡向正反应方向移动 B.使用催化剂,C的物质的量分数增加
C.化学方程式系数a<c+d D.根据图象无法确定改变温度后平衡移动方向
难度: 困难查看答案及解析
-
常温下,在20.00 mL 0.100 0 mol·L-1NH3·H2O溶液中逐滴滴加0.100 0 mol·L-1HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是( )
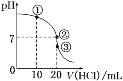
A.①溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.②溶液:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
C.①、②、③三点所示的溶液中水的电离程度②>③>①
D.滴定过程中不可能出现:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
难度: 困难查看答案及解析