-
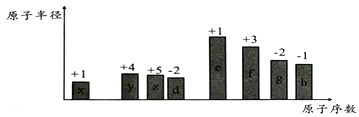
几种短周期元素的原子半径及主要化合价如下表所示
元素符号
X
Y
Z
W
原子半径/nm
0.160
0.143
0.070
0.066
主要化合价
+2
+3
+3,+5,-3
-2
下列有关叙述正确的是( )
A. 四种元素位于元素周期表的同一周期
B. 电解X的氯化物的水溶液可以得到单质X
C. Y的最高价氧化物对应的水化物既能溶解在盐酸中,又能溶解在氨水中
D. W、Z的氢化物均多于1种
难度: 中等查看答案及解析
-
四种短周期元素在周期表中的相对位置如下图所示,Y元素原子最外层电子数是其电子层数的3倍。下列说法正确的是( )
X
Y
Z
W
A.四种元素的原子半径最大的是W B.单质Z与Y2反应生成化合物ZY3
C.氢化物的稳定性:X>Y D.最高价氧化物对应水化物的酸性:W>X
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如下表所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )
Y
Z
X
W
A.原子半径:X<Y<Z
B.气态氢化物的稳定性:X>Z
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
难度: 中等查看答案及解析
-
某元素的最高价氧化物对应的水化物的分子式是H4RO4,则其氢化物的分子式是( )
A.RH3 B.H2R C.RH4 D.HR
难度: 简单查看答案及解析
-
下列叙述中,不能说明X元素比Y元素的非金属性强的是
A.与H2化合时,X单质比Y单质容易
B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强
C.X的原子序数比Y原子的原子序数大
D.X单质氧化性比Y单质的氧化性强
难度: 中等查看答案及解析
-
下列关于原子结构、元素性质的说法正确的是( )
A. 非金属元素组成的化合物中只含共价键
B. ⅠA族金属元素是同周期中金属性最强的元素
C. 同种元素的原子均有相同的质子数和中子数
D. ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
难度: 中等查看答案及解析
-
下列原子中,最容易形成阳离子的是
A.
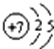 B.
B.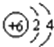 C.
C.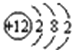 D.
D.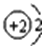
难度: 简单查看答案及解析
-
关于元素周期表的说法,不正确的是( )
A.元素周期表有7个周期
B.元素周期表中元素的排列依据是原子的核电荷数
C.同周期的元素,最外层电子数相同
D.同主族的元素,最外层电子数相同
难度: 中等查看答案及解析
-
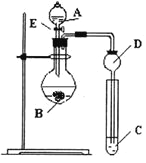
利用下列实验装置及药品能实现相应实验目的的是
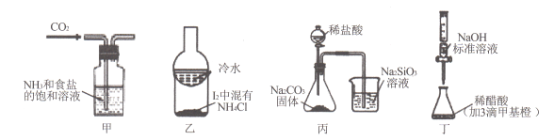
A. 甲用于制取NaHCO3晶体 B. 乙用于分离I2和NH4Cl
C. 丙用于证明非金属性强弱:Cl>C>Si D. 丁用于测定某稀醋酸的物质的量浓度
难度: 中等查看答案及解析
-
下列有关元素周期表的说法中,错误的是
A.主族元素分布于短周期和长周期里,而副族元素仅分布于长周期里
B.元素周期表中,位于同一主族的元素的原子最外层电子数相同,且等于族序数
C.元素周期表中,周期的序数就是该周期元素原子具有的电子层数
D.元素周期表有7个横行,7个周期;18个纵列,18个族
难度: 简单查看答案及解析
-
现有部分元素的原子结构特点如表,下列叙述中正确的是( )
X
L层电子数是K层电子数的3倍
Y
核外电子层数等于原子序数
Z
L层电子数是K层和M层电子数之和
W
共用三对电子形成双原子分子,常温下为气体单质
A.W原子结构示意图为
B.元素X和Y只能形成原子个数比为1∶2的化合物
C.元素X比元素Z的非金属性强
D.X、Y、Z、W四种元素不能形成离子化合物
难度: 中等查看答案及解析
-
下列事实与元素周期律相关知识无关的是
A.向淀粉KI 溶液中滴入溴水,溶液变蓝
B.NaOH、Mg(OH)2、Al(OH)3的碱性依次减弱
C.金属钠燃烧呈现黄色火焰,金属钾燃烧呈现紫色火焰
D.F2和H2暗处化合爆炸,而Cl2和H2化合需光照或点燃
难度: 中等查看答案及解析
-
下列关于周期表的说法正确的是( )
A.同一周期元素原子的最外层电子数相同
B.同一主族元素原子的电子层数相同
C.能生成碱的金属都在第ⅠA族
D.第三周期有8种元素
难度: 简单查看答案及解析
-
下列关于卤素(F、Cl、Br、I)叙述正确的是( )
A.其单质在常压下的沸点,随着卤素核电荷数的增多逐渐降低
B.单质和水反应通式:X2+H2O=HX+HXO(用X表示卤素),剧烈程度随着核电荷数的增多而减弱
C.单质和氢气反应的通式:X2+H2=2HX(条件不同),剧烈程度随着卤素核电荷数的增多而减弱
D.随着卤素核电荷数的增多,单质的氧化性逐渐增强
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X、Y的最外层电子数之和与Z的最外层电子数相等,W的简单氢化物与Z的单质在集气瓶中混合后,放置在光源下发生反应,气体颜色由黄绿色不断变浅且瓶壁上有油状物生成。下列说法错误的是( )
A.常压下,常见单质的沸点:
B.X离子的电子层结构与Y离子的相同
C.X与Z形成的二元化合物的水溶液呈中性
D.Z分别与W、Y形成的二元化合物所含化学键类型相同
难度: 中等查看答案及解析
-
某元素的原子结构示意图为
,下列关于该元素的说法中,错误的是( )
A.它是一种金属元素 B.它的阳离子有10个质子
C.它的阳离子带3个单位正电荷 D.其原子核外有13个电子
难度: 简单查看答案及解析
-
X、Y、Z是周期表中相邻的三元素,X和Y同周期,Y和Z同主族,三原子的最外层电子数之和为14,质子数之和为28,则三元素为( )
A.N、P、O B.N、C、Si C.C.B、Mg、Al D.C、N、P
难度: 中等查看答案及解析
-
下列各表是元素周期表的一部分,表中数字表示的原子序数与其在周期表中的位置相符的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
Na和Na+两种粒子中,不相同的是 ( )
①核内质子数;②核外电子数;③最外层电子数;④核外电子层数
A.①、② B.②、③ C.②、③、④ D.①、③
难度: 简单查看答案及解析
-
核电荷数小于18的某元素X,其原子核外电子层数为a,最外层电子数为(2a+l)。下列有关元素X的说法中,不正确的是
A.元素X的原子核内质子数可能为(2a2-l)
B.元素X形成的单质既能作氧化剂又能作还原剂
C.元素X形成的简单离子,各电子层的电子数均达到2n2个(n表示电子层数)
D.由元素X形成的某些化合物,可能具有杀菌消毒的作用
难度: 中等查看答案及解析
-
RO3n﹣中共有x个电子,R原子的质量数为A,则a克RO3n﹣中含有质子的物质的量( )
A.
(x﹣n)mol B.
(x﹣24﹣n)mol
C.(x﹣n)mol D.
(x﹣n)mol
难度: 简单查看答案及解析