-
化学与生活密切相关,下列说法不正确的是
A. 将燃油车改为燃气车有利于减少污染物排放
B. 含氟牙膏能有效预防龋齿,且其中所加氟化物的量宜多不宜少
C. 糖类、油脂及蛋白质都含有C、H、O元素
D. 酸雨浸蚀的土壤中加入熟石灰,可对该土壤进行修复
难度: 简单查看答案及解析
-
下列生活用品的主要成分是蛋白质的是
A. 羽绒被 B. 有机玻璃 C. 面巾纸 D. 涤纶布
难度: 简单查看答案及解析
-
在水溶液中能大量共存的一组粒子是
A. S2O32-、Na+、Cl-、H+ B. Na+、Mg2+、Cl--、SO42-
C. Ba2+、Na+、SO42-、OH- D. K+、C2H5OH、MnO4-、H+
难度: 中等查看答案及解析
-
《验方新编》中有如下叙述:“凡暑月身热昏沉,未明症候,恐是出丹。用生白扁豆数粒食之. 如不知腥味,则以生白扁豆、水泡湿,研汁一小杯,调水一盏服之。即愈。”文中涉及的操作方法是
A. 蒸馏 B. 升华 C. 浸取 D. 分液
难度: 简单查看答案及解析
-
下列关于有机物的说法正确的是
A. 石油的催化重整、煤的干馏均可以得到芳香烃
B. 乙酸、草酸均不能使酸性高锰酸钾溶液褪色
C. 新戊烷的所有碳原子位于同一平面
D. 奶油、鸡蛋清均属于高分子化合物且均能发生水解反应
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 标准状况下,2.24L由O2和O3组成的混合气体中含有的原子数为0.2NA
B. 1L0.1mol·L-1NaHCO3溶液中所含HCO3-的数目为0.1NA
C. 一定条件下,0.1molCO与0.1molH2O(g)充分反应,生成H2的分子数为0.1NA
D. 在反应:3FeS2+12C+8O2==Fe3O4+12CO+6S中,每生成0.6molS,转移的电子数为3.2NA
难度: 中等查看答案及解析
-
自然界中三种单萜的结构如图所示。下列说法不正确的是
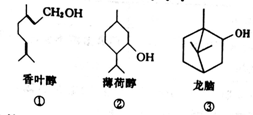
A. ①、③互为同分异构体 B. ②的分子式为C10H18O
C. ①能使酸性高锰酸钾溶液褪色 D. ①、②、③都能与金属钠反应
难度: 中等查看答案及解析
-
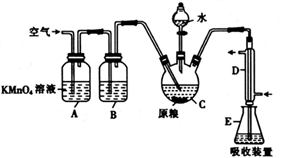
实验室用H2还原SiHCl3(沸点:31.85℃)制备纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是( )
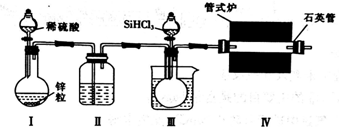
A. 装置Ⅱ、Ⅲ中依次盛装的是浓H2SO4、冰水
B. 实验时,应先加热管式炉,再打开盛装稀硫酸的分液漏斗
C. 为鉴定制得的硅中是否含微量铁单质,需要用到的试剂为盐酸、双氧水、硫氰化钾溶液
D. 该实验中制备氢气的装置也可用于氧氧化钠稀溶液与氯化铵固体反应制备氨气
难度: 困难查看答案及解析
-
下列各组物质中,任意两种物质在常温下均能发生反应的是( )
选项
甲
乙
丙
A
NH3
CuO
稀 HNO3
B
A1
盐酸
Fe2O3
C
Si
O2
H2
D
SO2
NaOH溶液
新制氯水
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
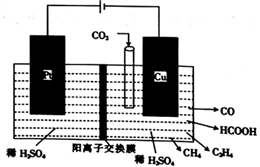
某工厂用电解法处理含有SO2的尾气,其装置如图所示(电极材料均为惰性电极)。下列说法不正确的是
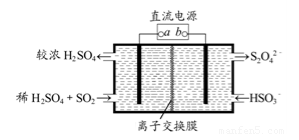
A. 电极a连接的是电源的正极
B. 若电路中转移0.03mole-,则离子交换膜左侧溶液中增加0.03mol离子
C. 图中的离子交换膜是阳离子交换膜
D. 阴极的电极反应式为2HSO3-+2e-+2H+==S2O42-+2H2O
难度: 困难查看答案及解析
-
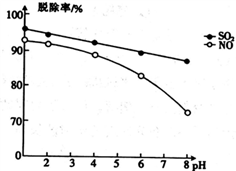
下列实验操作对应的现象及结论都正确的是
选项
实验操作
现象
结论
A
分別向饱和NaHCO3溶液和饱和NaHSO3溶液中滴加几滴石蕊试剂
前者溶液不变色,后者溶液变红
非金属性:S>C
B
甲烷与氯气的混合气在光照下反应,用湿润 的蓝色石蕊试纸检验反应后生成的气体
湿润的蓝色石蕊试纸变红
甲烷的氯代物呈酸性
C
向NaAlO2溶液中持续通入气体Y
先出现白色沉淀,最终沉淀又溶解
Y可能是HCl
D
向溴水中通入SO2
溴水橙黄色褪去
SO2具有漂白性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
用海水制盐工业中的母液来生产金属镁的一种工艺流程如下:
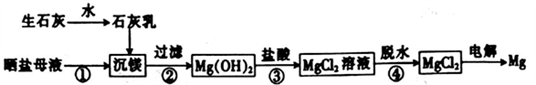
下列说法错误的是
A. 上述工艺流程中未涉及置换反应
B. 设计步骤①、②、③的主要目的是富集MgCl2
C. 脱水时在HC1气氛中进行可防止MgCl2发生水解
D. 电解得到的炽热镁粉可在二氧化碳气氛中冷却
难度: 中等查看答案及解析
-
W、X、Y、Z是原子序数依次增大的短周期主族元素,X的单质经常作为保护气,这四种元素可以组成阴阳离子个数比为1∶1的离子化合物。由Y、Z形成的一种化合物可与由W、Z 形成的化合物反应,生成淡黄色固体。下列说法中不正确的是
A. 最简单气态氢化物的热稳定性:Y<Z
B. X、Y的简单离子具有相同的电子层结构
C. XW3可使湿润的红色石蕊试纸变蓝
D. Y与X属于同一周期,与Z属于同一主族
难度: 中等查看答案及解析
-
常温下将NaOH溶液滴入二元弱酸H2X溶液中,混合溶液中的离子浓度与溶液pH的变化关系如图所示。下列叙述正确的是
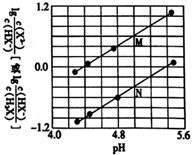
A. Kal(H2X)的数量级为10-7
B. 曲线N表示lg
与pH的变化关系
C. NaHX溶液中:c(H+)<c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(X2-)>c(HX-)> c(H+)=c(OH-)
难度: 困难查看答案及解析
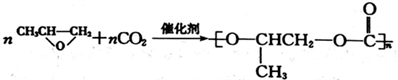
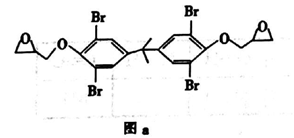
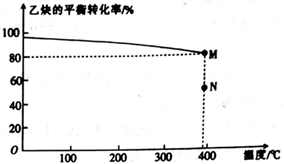
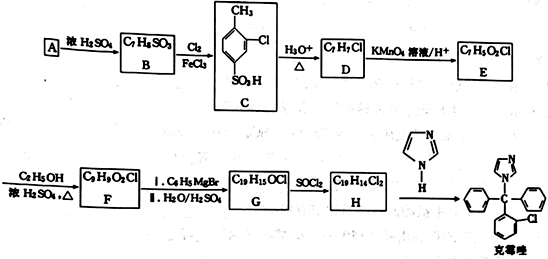
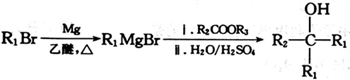
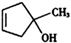 的合成路线。____________________________________
的合成路线。____________________________________