-
列有关金属腐蚀的说法中错误的是
A.纯银饰品久置表面变暗属于化学腐蚀
B.电化学腐蚀和化学腐蚀都是金属被氧化的过程,伴随有电流产生
C.金属发生的电化学腐蚀比化学腐蚀要普遍的多
D.温度越高,金属发生化学腐蚀的速率越快
难度: 中等查看答案及解析
-
下列有关金属防护的说法中错误的是
A.金属表面涂油漆,可避免金属与电解质溶液接触
B.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
C.铁管镀锌层局部破损后,铁管仍不易生锈
D.将钢闸门与直流电源的正极相连可防止其被腐蚀
难度: 中等查看答案及解析
-
铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图所示。下列说法不正确的是
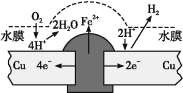
A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀
B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小
C.铜极上的反应是2H++2e− =H2↑、O2+4e−+4H+=2H2O
D.在金属表面涂一层油脂,能防止铁铆钉被腐蚀
难度: 中等查看答案及解析
-
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致现象的主要原因是液滴之下氧气含量比边缘处少。下列说法正确的是( )
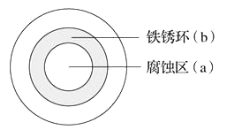
A.液滴中的Cl–由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH−形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-=Cu2+
难度: 中等查看答案及解析
-
下列与金属腐蚀有关的说法正确的是( )
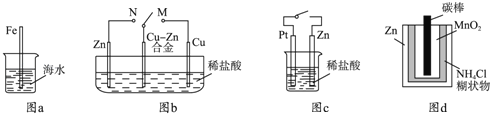
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
难度: 中等查看答案及解析
-
我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是

A. 通电时,锌环是阳极,发生氧化反应
B. 通电时,阴极上的电极反应为2H2O+2e-=H2↑+2OH-
C. 断电时,锌环上的电极反应为Zn2++2e-=Zn
D. 断电时,仍能防止铁帽被腐蚀
难度: 中等查看答案及解析