-
中华传统文化博大精深,下列说法正确的是( )
A.“霾尘积聚难见路人”,雾和霾是气溶胶,具有丁达尔效应
B.“杨花榆荚无才思”中的“榆荚”主要成分为蛋白质
C.“日照香炉生紫烟”中的紫烟指“碘的升华”
D.“火树银花不夜天”指的是金属单质的焰色反应
难度: 简单查看答案及解析
-
下表为各物质中所含少量杂质以及除去这些杂质应选用的试剂或操作方法正确的一组是( )
选项
物质(括号为少量杂质)
除杂方法
A
CO2(SO2)
通入饱和碳酸氢钠溶液,再通入碱石灰干燥
B
Cu(CuO)
空气中加热
C
FeCl2(Fe)
通入少量氯气加热
D
KNO3(NaCl)
溶于水配成热饱和溶液,冷却结晶
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列对化学用语的理解正确的是( )
A.乙烯的结构简式:CH2CH2
B.电子式
可以表示氢氧根离子,也可以表示羟基
C.比例模型
 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子D.结构示意图
 可以表示35Cl-,也可以表示37Cl-
可以表示35Cl-,也可以表示37Cl-难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标况下,22.4LCl2溶于足量水,所得溶液中Cl2、Cl-、HClO和ClO-四种微粒总数为NA
B.标准状况下,38g3H2O2中含有4NA共价键
C.常温下,将5.6g铁块投入一定量浓硝酸中,转移0.3NA电子
D.一定温度下,1L0.50mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液含NH4+的物质的量一定不相同
难度: 中等查看答案及解析
-
炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是( )
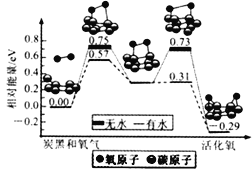
A. 氧分子的活化包括O-O键的断裂与C-O键的生成
B. 每活化一个氧分子放出0.29eV的能量
C. 水可使氧分子活化反应的活化能降低0.42eV
D. 炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
难度: 中等查看答案及解析
-
下列解释事实的离子方程式正确的是( )
A.用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:Na2S2O3+2H+=SO2↑+S↓+2Na++H2O
B.硝酸铁溶液中加入少量碘化氢:2Fe3++2I-=2Fe2++I2
C.向NaClO溶液中通入少量CO2制取次氯酸:ClO-+H2O+CO2=HClO+HCO3-
D.硫酸铝铵与氢氧化钡以1:2混合形成的溶液:Al3++2SO42-+2Ba2++4OH-=BaSO4↓+AlO2-+2H2O
难度: 中等查看答案及解析
-
下列实验能实现的是( )
A.
 图1装置左侧用于检验氯化铵受热分解出的氨气
图1装置左侧用于检验氯化铵受热分解出的氨气B.
 图2装置用于分离碘单质和高锰酸钾固体混合物
图2装置用于分离碘单质和高锰酸钾固体混合物C.
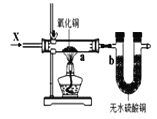 图3装置中若a处有红色物质生成,b处变蓝,证明X一定是H2
图3装置中若a处有红色物质生成,b处变蓝,证明X一定是H2D.
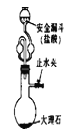 图4装置可以制取少量CO2,安全漏斗可以防止气体逸出
图4装置可以制取少量CO2,安全漏斗可以防止气体逸出难度: 中等查看答案及解析
-
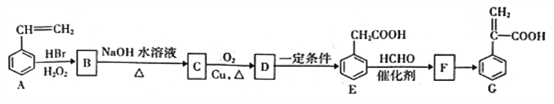
对如图有机物的说法正确的是( )
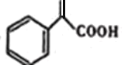
A.属于苯的同系物
B.如图有机物可以与4molH2加成
C.如图有机物中所有的碳一定都在同一平面上
D.如图有机物与钠、氢氧化钠、碳酸钠、碳酸氢钠都能反应
难度: 中等查看答案及解析
-
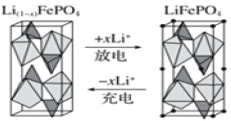
科学工作者研发了一种 SUNCAT的系统,借助锂循环可持续合成氨,其原理如下图所示。下列说法不正确的是
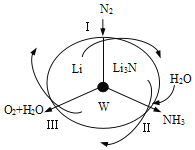
A. 过程I得到的Li3N中N元素为—3价
B. 过程Ⅱ生成W的反应为Li3N+3H2O===3LiOH+NH3↑
C. 过程Ⅲ中能量的转化形式为化学能转化为电能
D. 过程Ⅲ涉及的反应为4OH--4e-=O2↑+2H2O
难度: 困难查看答案及解析
-
某溶液中可能含有离子:K+、Na+、Fe2+、Fe3+、SO32-、SO42-,且溶液中各离子的物质的量相等,将此溶液分为两份,一份加高锰酸钾溶液,现象为紫色褪去,另一份加氯化钡溶液,产生了难溶于水的沉淀。下列说法正确的是( )
A.若溶液中含有硫酸根,则可能含有K+
B.若溶液中含有亚硫酸根,则一定含有K+
C.溶液中可能含有Fe3+
D.溶液中一定含有Fe2+和SO42-
难度: 困难查看答案及解析
-
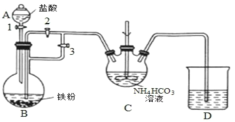
“侯氏制碱法”是我国化工专家侯德榜为世界制碱工业作出的突出贡献。某实验小组模拟“侯氏制碱法”的工艺流程及实验装置(部分夹持装置省略)如图:下列叙述正确的是( )

A.实验时先打开装置③中分液漏斗的旋塞,过一段时间后再点燃装置①的酒精灯
B.装置②的干燥管中可盛放碱石灰,作用是吸收多余的NH3
C.向步骤 I 所得滤液中通入氨气,加入细小的食盐颗粒并降温可析出NH4Cl
D.用装置④可实现步骤Ⅱ的转化,所得CO2可循环使用
难度: 中等查看答案及解析
-
中科院设计了一种新型的多功能复合催化剂,实现了CO2直接加氢制取高辛烷值汽油,其过程如图。下列有关说法正确的是( )

A.在Na-Fe3O4上发生的反应为CO2+H2=CO+H2O
B.中间产物Fe5C2的生成是实现CO2转化为汽油的关键
C.催化剂HZMS-5可以提高汽油中芳香烃的平衡产率
D.该过程,CO2转化为汽油的转化率高达78%
难度: 中等查看答案及解析
-
W、X、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应生成盐和水,向一定量的W的最高价氧化物对应的水化物溶液中逐滴加人XZ3溶液,生成的沉淀X(OH)3的质量随XZ3溶液加人量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
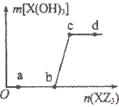
A.d点对应的溶液中:K+、NH4+、CO32-、I-
B.c点对应的溶液中:Ag+、Ca2+、NO3-、Na+
C.b点对应的溶液中:Na+、S2-、SO42-、Cl-
D.a点对应的溶液中:Na+、K+、S042-、HCO3-
难度: 困难查看答案及解析
-
以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中,不正确的是

A. 反应1中,每生成1 mol ClO2有0.5 mol SO2被氧化
B. 从母液中可以提取Na2SO4
C. 反应2中,H2O2做氧化剂
D. 采用减压蒸发可能是为了防止NaClO2受热分解
难度: 困难查看答案及解析
-
在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3−)以达到消除污染的目的。其工作原理的示意图如下:
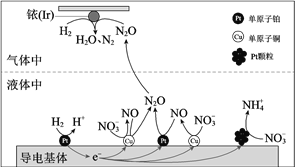
下列说法不正确的是
A. Ir的表面发生反应:H2 + N2O=N2 + H2O
B. 导电基体上的负极反应:H2-2e−=2H+
C. 若导电基体上只有单原子铜,也能消除含氮污染物
D. 若导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量
难度: 中等查看答案及解析
-
25℃时,向0.1mol/LCH3COOH溶液中逐渐加入NaOH固体,恢复至原温度后溶液中的关系如图所示(忽略溶液体积变化)。下列有关叙述不正确的是( )
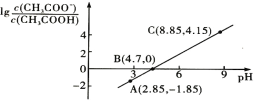
A.CH3COOH的Ka=1.0×10-4.7
B.C点的溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.B点的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
D.A点的溶液中:c(CH3COO-)+c(H+)+c(CH3COOH)-c(OH-)=0.1mol/L
难度: 中等查看答案及解析
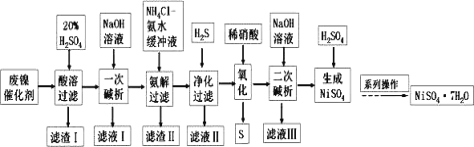


 。
。