-
[四川省绵阳市2019届高三第三次诊断性考试]化学与科技、社会、生产密切相关,下列说法错误的是
A. 我国出土的青铜礼器司母戊鼎是铜和铁的合金
B. 高纯硅具有良好的半导体性能,可用于制光电池
C. 港珠澳大桥钢筋表面的环氧树脂涂层属于合成高分子材料
D. 火箭推进剂使用煤油-液氧比偏二甲肼-四氧化二氮的环境污染小
难度: 简单查看答案及解析
-
由下列实验现象一定能得出相应结论的是
选项
A
B
C
D
装置图
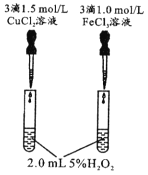
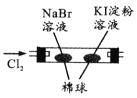
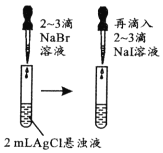
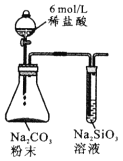
现象
右边试管产生气泡较快
左边棉球变棕黄色,右边棉球变蓝色
试管中先出现淡黄色固体,后出现黄色固体
试管中液体变浑浊
结论
催化活性:Fe3+>Cu2+
氧化性:Br2>I2
Ksp:AgCl>AgBr>AgI
非金属性:C>Si
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
屠呦呦因发现治疗疟疾的青蒿素和双氢青蒿素(结构如图)获得诺贝尔生理学或医学奖.一定条件下青蒿素可以转化为双氢青蒿素.下列有关说法中正确的是

A. 青蒿素的分子式为C15H20O5
B. 双氢青蒿素能发生氧化反应、酯化反应
C. 1 mol青蒿素最多能和1 molBr2发生加成反应
D. 青蒿素转化为双氢青蒿素发生了氧化反应
难度: 中等查看答案及解析
-
用废铁屑制备磁性胶体粒子,制取过程如下:
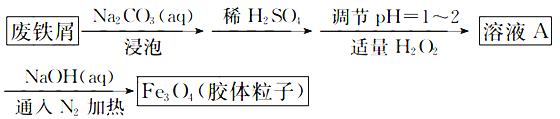
下列说法不正确的是
A.用Na2CO3溶液浸泡是为了除去废铁屑表面的油污
B.通入N2是防止空气中的O2氧化二价铁元素
C.加适量的H2O2是为了将部分Fe2+氧化为Fe3+,涉及反应:H2O2+2Fe2++2H+=2Fe3++2 H2O
D.溶液A中Fe2+和Fe3+的浓度比为2:1
难度: 中等查看答案及解析
-
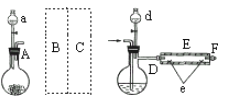
处理烟气中的SO2可以采用碱吸——电解法,其流程如左图;模拟过程Ⅱ如右图,下列推断正确的是
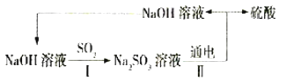
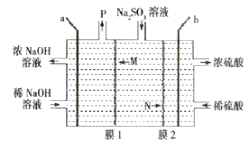
A. 膜1为阴离子交换膜,膜2为阳离子交换膜
B. 若用锌锰碱性电池为电源,a极与锌极相连
C. a极的电极反应式为2H2O一4e一=4H++O2↑
D. 若收集22.4L的P(标准状况下),则转移4mol电子
难度: 中等查看答案及解析
-
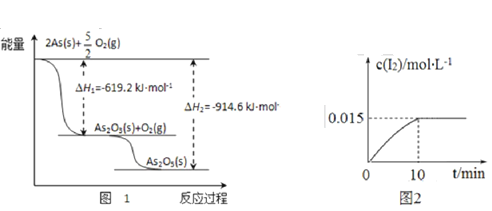
改变0.01mol/LNaAc溶液的pH,溶液中HAc、Ac-、H+、OH-浓度的对数值lgc与溶液pH的变化关系如图所示。若pKa=-lgKa,下列叙述错误的是

A. 直线b、d分别对应H+、OH-
B. pH=6时,c(HAc)>c(Ac-)>c(H+)
C. HAc电离常数的数量级为10-5
D. 从曲线a与c的交点可知pKa=pH=4.74
难度: 困难查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示。下列说法正确的是
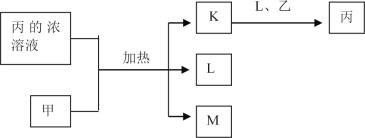
A.原子半径:W<X<Y B.元素的非全属性:Z>Y>X
C.化合物XYZ中只含共价键 D.K、L、M中沸点最高的是M
难度: 困难查看答案及解析