-
化学与生活、人类生产、社会可持续发展密切相关,下列说法正确的是
A.合成材料、光伏材料和复合材料都是新型无机非金属材料
B.大米、.玉米、小麦中的淀粉经水解可变成乙醇
C.利用二氧化碳制造全降解塑料,可以减少白色污染
D.煤的干馏是化学变化,煤的气化、液化和石油的分馏都是化学变化
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列叙述正确的是
A.标准状况下,22.4 L Cl2通入到水中,则溶液中n(HClO) +n(Cl-)+n(ClO- )=2 mol
B.0.1 mol铁粉与足量水蒸气在高温下反应,生成的H2分子数为0.15NA
C.常温下,15g- CH3和17 gNH3所含电子数相等
D.25 °C时,1.0 L pH= 12的NaClO溶液中由水电离出的OH-的数目为0.01NA
难度: 中等查看答案及解析
-
四种位于不同主族的短周期元素X、Y、Z、W的原子序数依次增大,
的内层电子与最外层电子数之比为2:5,Z和W位于同一周期。Z与W组成的化合物是常用的调味品,也是重要的医用药剂,工业上电解该化合物的熔融物可制得Z单质,Y和Z可形成两种离子化合物,这两种离子化合物的阴离子与阳离子数之比均为1:2。下列说法正确的是
A. 四种元素中至少有两种金属元素
B. 四种元素的常见氢化物中熔点最高的是
的氢化物
C. 四种元素形成的简单高子中,离子半径最小的是元素
形成的离子
D. 常温下,
三种元素形成的化合物的水溶液的
小于7
难度: 中等查看答案及解析
-
如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是
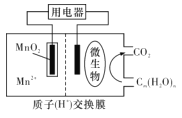
A.放电过程中,H+从正极区移向负极区
B.微生物所在电极区放电时发生还原反应
C.若用该电池给铅蓄电池充电,MnO2电极质量减少8.7g,则铅蓄电池负极增重9.6g
D.正极反应式为MnO2+4H++2e-=Mn2++2H2O
难度: 简单查看答案及解析
-
某化学兴趣小组从含有KI、KNO3等成分的工业废水中回收I2和KNO3 ,其流程如下:
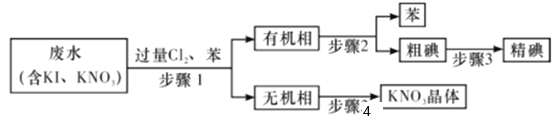
下列说法正确的是
A.步骤1中有机相应从分液漏斗下端放出,无机相从上口倒出
B.步骤2分离方法为过滤
C.步骤3可在装置
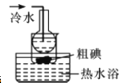 中完成
中完成D.步骤4中,将溶液蒸发至只剩少量水时,用余热蒸干
难度: 中等查看答案及解析
-
香天竺葵醇和异香天竺葵醇可用于精油的制作,其结构简式如图,下列叙述正确的是
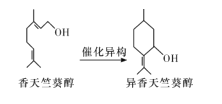
A.异香天竺葵醇分子中的所有碳原子不可能处于同一平面
B.两者都能发生加成反应,但不能发生取代反应
C.香天竺葵醇属于脂肪醇,异香天竺葵醇属于芳香醇
D.两者都能使酸性高锰酸钾溶液褪色,异香天竺葵醇分子中存在3个手性碳原子
难度: 中等查看答案及解析
-
已知:溶液中存在2CrO42- +2H+
Cr2O72- + H2O。25℃时,调节初始浓度为1.0mol·L-1 Na2CrO4溶液的pH(溶液体积变化忽略不计),溶液中-lgc(Cr2O72-)与-lg[c(CrO42-)·c(H+)]的关系如图所示。下列说法错误的是
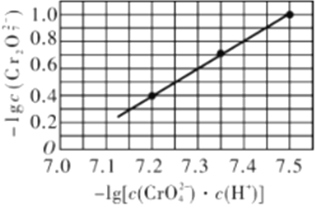
A.若将原溶液加少量水稀释,溶液中
的值增大
B.当c(Cr2O72-)=c(CrO42- )时溶液的pH<7
C.反应的平衡常数K=1×1014
D.若只升高温度,c(CrO42-)增大,则该反应的∆H<0
难度: 中等查看答案及解析
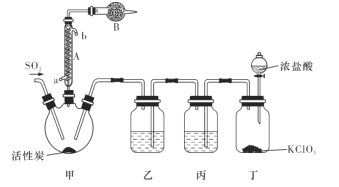
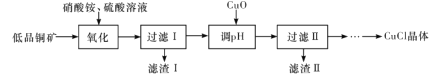
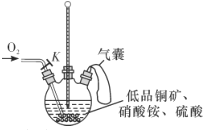
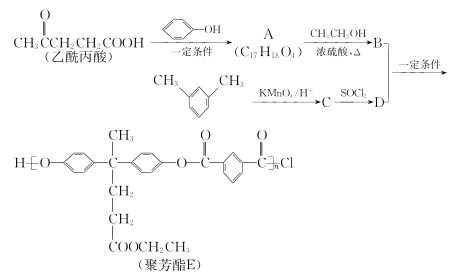
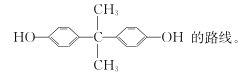 ____
____