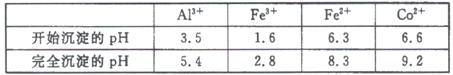
-
设NA为阿伏加德罗常数的值,下列叙述中正确的是
A. 含0.2 mol Na2O和0.8 molNa2O2的混合物中离子总数为3NA
B. 标准状况下,22.4LCH2Cl2含有共用电子对数目为4NA
C. 1L1mol·L-1CH3CH2OH水溶液中含-OH的数目为NA
D. 将71gCl2通入足量NaOH溶液中,反应转移电子数为2NA
难度: 中等查看答案及解析
-
高铁酸钾是一种新型、高效、多功能水处理剂,工业上采用向KOH溶液中通入氯气,然后再加入Fe(NO3)3溶液的方法制备K2FeO4,发生反应:
①C12+KOH→KC1+KC1O+KC1O3+H2O(未配平);
②2Fe(NO3)3+3KC1O+10KOH===2K2FeO4+6KNO3+3KC1+5H2O。
下列说法正确的是
A.若反应①中n(ClO-):n(C1O3-)=5:1,则氧化剂与还原剂的物质的量之比为2:1
B.反应①中每消耗4molKOH,吸收标准状况下22.4LCl2
C.氧化性:K2FeO4>KC1O
D.若反应①的氧化产物只有KC1O,则得到0.2molK2FeO4时消耗0.3molC12
难度: 简单查看答案及解析
-
化学与生产、生活密切相关,下列说法不正确的是( )
A.“东方超环(被称为人造太阳)”使用的氘、氚与氕互为同位素
B.采用雾化技术燃煤的目的是提高煤燃烧效率和减少SO2排放
C.过氧碳酸钠(2Na2CO3·3H2O2)可以用作去污剂、消毒剂
D.“玉兔二号”月球车首次实现在月球表面着陆,其太阳能电池帆板的材料是硅
难度: 简单查看答案及解析
-
在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示:
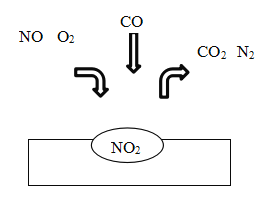
下列说法不正确的是
A. 该转化过程中有3种元素的化合价发生变化
B. NO 和O2必须在催化剂表面才能反应
C. 该装置将有毒的NO和CO转化为无毒的CO2和N2
D. 该催化转化的总反应方程式为:2NO+O2+4CO
4CO2+N2
难度: 中等查看答案及解析
-
某药物中间体的合成路线如下。下列说法正确的是
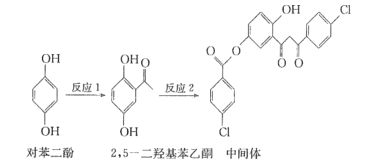
A. 1mol对苯二酚与足量H2加成,消耗3molH2
B. 2, 5-二羟基苯乙酮不能使酸性KMnO4溶液褪色
C. 2, 5-二羟基苯乙酮中所有碳原子一定处于同一平面
D. 中间体分子中含有的官能团之一是碳碳双键
难度: 中等查看答案及解析
-
正在研发的锂空气电池能量密度高、成本低,可作为未来电动汽车的动力源,其工作原理如图。下列有关该电池的说法正确的是
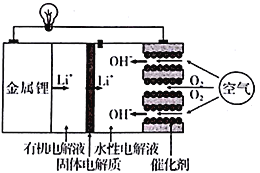
A. 有机电解液可以换成水性电解液
B. 放电时,外电路通过2 mol 电子,消耗氧气11.2 L
C. 放电和充电时,Li+迁移方向相同
D. 电池充电时,在正极上发生的反应为4OH--4e-= O2↑+2H2O
难度: 中等查看答案及解析
-
常温下联氨(N2H4)的水溶液中有:
①N2H4+H2O
N2H5++OH- K1
②N2H5++H2O
N2H62++OH- K2
(提示:二元弱碱的电离也是分步电离)
该溶液中的微粒的物质的量分数δ(X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是( )
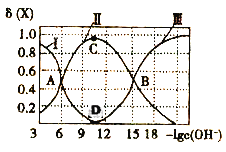
A.据A点可求:K1=10-6
B.D点溶液的c(OH-)=10-l1
C.若C点为N2H5Cl溶液,则存在:c(Cl-)>c(N2H5+)+2c(N2H62+)
D.在N2H5Cl水溶液中,c(N2H4)+c(OH-)=2c(N2H62+)+c(H+)
难度: 中等查看答案及解析

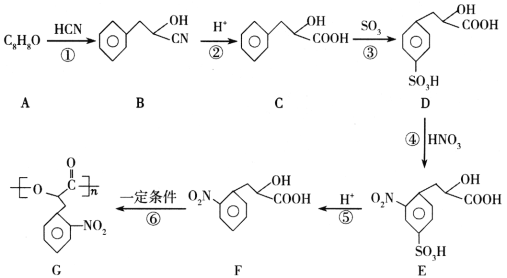
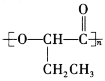 的合成路线:________。
的合成路线:________。