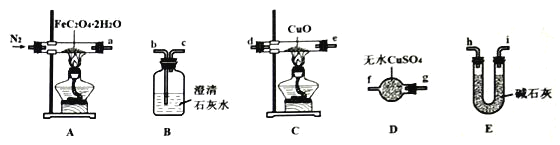
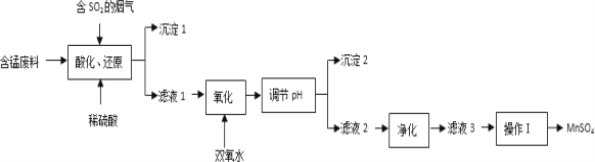
-
下列说法正确的是( )
A.“熔喷布”可用于制作N95型等口罩,生产“熔喷布”的主要原料是聚丙烯,它属于纯净物
B.“山东舰”上用于舰载机降落拦阻索的是一种特种钢缆,属于新型无机非金属材料
C.喝补铁剂(含Fe2+)时,加服维生素C效果更好,因维生素C具有抗氧化性
D.我国部分城市在推广使用的“甲醇汽油”,有降低排放废气的优点,无任何负面作用
难度: 简单查看答案及解析
-
设阿伏加德罗常数的值为NA。下列说法正确的是( )
A.5.6g乙烯和环丙烷的混合物中含C—H键数目为0.8NA
B.常温下,将2.8g铁块投入足量浓硝酸中,转移0.15NA电子
C.标准状况下,22.4LCl2溶于水,转移的电子数为NA
D.25℃时,pH=4的CH3COOH溶液中H+的数目为10-4NA
难度: 中等查看答案及解析
-
下列实验操作对应的现象或结论均正确的是( )
选项
操作
现象
结论
A
向H2O2溶液中滴加少量硫酸酸化的FeSO4溶液
溶液变为棕黄色后迅速出现大量气泡
Fe2+催化H2O2发生分解反应生成O2
B
将相同体积、相同pH的盐酸和醋酸溶液分别稀释a倍、b倍
稀释后溶液pH相同
a>b
C
向25mL沸水中滴加5~6滴FeCl3饱和溶液,继续煮沸
生成红褐色沉淀
制得Fe(OH)3胶体
D
相同温度下,测定等浓度的NaHCO3和NaHSO4溶液的pH
前者pH比后者的大
非金属性:S>C
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
一种免疫调节剂的结构简式如图所示,关于该物质的说法不正确的是( )
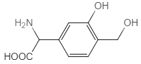
A.属于芳香族化合物,分子式为C9H11O4N
B.可以发生的反应类型有加成反应、氧化反应、聚合反应
C.分子中所有碳原子有可能在同一平面上
D.1mol该调节剂最多可以与3molNaOH反应
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、M、N的原子序数依次增大。X和M的原子核外最外层电子数是周期数的二倍,Y、Z、M最高价氧化物对应的水化物两两之间能相互反应。下列叙述正确的是
A.元素非金属性由弱到强的顺序:M、N、X
B.原子最外层电子数由少到多的顺序:Y、Z、X、M、N
C.电解熔融的N和Z形成的化合物可得到对应的N和Z的单质
D.单质Y的熔点高于单质Z的熔点
难度: 中等查看答案及解析
-
科学家研发了一种新型锂空气电池,结构如图所示。已知:①电解质由离子液体(离子能够自由移动,非溶液)和二甲基亚砜混合制成,可促进过氧化锂生成;②碳酸锂薄层的作用是让锂离子进入电解质,并阻止其他化合物进入;③二硫化钼起催化作用。下列叙述不正确的是( )
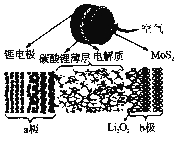
A. 放电时,a极发生氧化反应
B. 放电时的总反应是2Li+O2=Li2O2
C. 充电时,Li+在电解质中由b极移向a极
D. 充电时,b极的电极反应式为:Li2O2+2e-=2Li+ O22-
难度: 中等查看答案及解析
-
已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7;p(Ni)=-lgc(Ni2+),p(B)=-lgc(S2-)或-lgc(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示(已知两种沉淀的溶解度随温度升高而增大)。下列说法错误的是( )
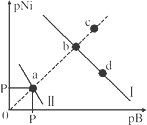
A.常温下NiCO3的溶解度大于NiS的溶解度
B.向d点对应的溶液中加入Na2S固体,d点向b点移动
C.对于曲线I,在b点加热,b点向c点移动
D.P为3.5且对应的阴离子是CO32-
难度: 中等查看答案及解析