-
不能由醛或酮加氢还原制得的醇是( )
A. CH3CH2OH B. CH3CH2CH(OH)CH3
C. (CH3)3CCH2OH D. (CH3)3COH
难度: 中等查看答案及解析
-
要合成带有放射性氧元素(*O)的乙酸乙酯,除必要的反应条件外,下列各组反应物能满足合成要求的是( )
①CH3CO*OH和C2H5OH
②CH3COOH和C2H5*OH
③CH3C*OOH和C2H5OH
④CH3CO*OH和C2H5*OH.
A. ①②③④ B. ①③④ C. ①②④ D. ②③④
难度: 中等查看答案及解析
-
下列物质中,不属于高分子化合物的是( )
A.葡萄糖 B.纤维素 C.淀粉 D.蛋白质
难度: 中等查看答案及解析
-
烷烃的通式是( )
A.CnH2n B.CnH2n-2 C.CnH2n+2 D.CnH2n-6
难度: 简单查看答案及解析
-
做完实验后的试管上沾有的苯酚,不能用来洗涤的试剂是
A.NaOH溶液 B.酒精 C.65℃以上的水 D.冷水
难度: 简单查看答案及解析
-
下列关于同分异构体判断正确的是( )
A.分子式为C2H6O的同分异构体有两个,分别是H3C-O-CH3和CH3CH2OH
B.分子式为C8H10的芳香烃有3个
C.分子式为C4H8的烯烃同分异构体有2个,分别为CH2=CHCH2CH3、CH3CH=CHCH3
D.二氯甲烷有两种同分异构体
难度: 中等查看答案及解析
-
下列混合物能用分液法分离的是 ( )
A.果糖与乙醚 B.苯和溴苯 C.葡萄糖和乙醚混合液 D.葡萄糖与果糖混合液
难度: 中等查看答案及解析
-
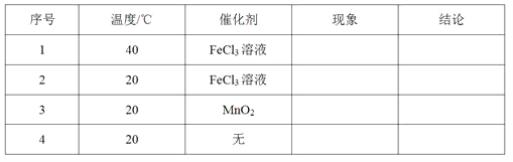
现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是
A. ④①②⑤⑥③ B. ④①②⑥⑤③ C. ①④②⑥③⑤ D. ①④②③⑥⑤
难度: 中等查看答案及解析
-
下列电离方程式中,正确的是( )
A.H2SO3
2H++SO32- B.Fe(OH)3=3OH-+Fe3+
C.H2CO3
2H++CO32- D.CH3COOH
H++CH3COO-
难度: 简单查看答案及解析
-
在一真空固定体积的密闭容器中,充入10mol N2和30mol H2混合后发生反应:N2+3H2
2NH3。在一定温度下达到平衡,H2的转化率为20%。若在同一容器中充入NH3, 欲使反应达到平衡时各成分的百分含量与上述平衡时相同,则起始时充入NH3的物质的量和达到平衡时NH3的转化率是
A.15mol 20% B.20mol 20% C.20mol 80% D.40mol 80%
难度: 困难查看答案及解析
-
把0.05molKOH固体分别加入下列100mL液体中,溶液的导电能力变化不大的是( )
A.自来水 B.0.5mol·L-1氯化钠溶液
C.0.5mol·L-1醋酸溶液 D.0.5mol·L-1氯化铵溶液
难度: 简单查看答案及解析
-
有关如下图所示原电池的叙述,正确的是(盐桥中装有含KCl饱和溶液的琼脂)( )
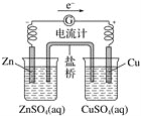
A.反应中,盐桥中的K+会移向CuSO4溶液
B.取出盐桥后,电流计依然发生偏转
C.铜片上有气泡逸出
D.反应前后铜片质量不改变
难度: 简单查看答案及解析
-
已知25 ℃、101 kPa下,碳、氢气、乙烯和葡萄糖的燃烧热依次是393.5 kJ·mol-1、285.8 kJ·mol-1、1 411.0 kJ·mol-1、2 800 kJ·mol-1,则热化学方程式正确的是( )
A.C(s)+1/2O2(g)=CO(g) ΔH=-393.5 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(g) ΔH=+571.6 kJ·mol-1
C.C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH=-1 411.0 kJ·mol-1
D.1/2 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
难度: 简单查看答案及解析
-
某可逆反应mA(g)+nB(g)
qC(g),△H在密闭容器中进行。如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况。下列推断正确的是
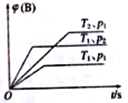
A.p1>p2,T1<T2,m+n>q,△H<0
B.p1<p2,T1>T2,m+n>q,△H>0
C.p1>p2,T1<T2,m+n<q,△H<0
D.p1<p2,T1>T2,m+n<q,△H>0
难度: 中等查看答案及解析
-
某种溶质的溶液的pH=2,向该溶液中加水到体积变为原来溶液体积的10倍,所得溶液的pH在2~3之间,则溶液中的溶质可能是( )
A.强酸 B.弱酸 C.强碱 D.弱碱
难度: 简单查看答案及解析
-
已知在Ca3(PO4)2的饱和溶液中,c(Ca2+)=2.0×10-6mol•L-1,c(PO43-)=1.58×10-6mol•L-1,则Ca3(PO4)2的Ksp为( )
A.2.0×10-29 B.3.2×10-12 C.6.3×10-18 D.5.1×10-27
难度: 中等查看答案及解析
-
已知AgCl的溶解平衡:AgCl(s)
Ag+(aq)+Cl-(aq),下列说法不正确的是( )
A.除去溶液中Ag+加盐酸比硫酸盐好
B.加入H2O,溶液平衡不移动
C.用NaCl溶液代替蒸馏水洗涤AgCl,可以减少沉淀损失
D.反应2AgCl(s)+Na2S
Ag2S(s)+2NaCl说明溶解度:AgCl>Ag2S
难度: 中等查看答案及解析
-
下列各反应的化学方程式中,属于水解反应的是( )
A.H2O+ H2O
H3O++OH-
B.CO2+H2O
H2CO3
C.HCO3-+OH-
H2O+CO32-
D.CO32-+ H2O
HCO3- +OH-
难度: 中等查看答案及解析
-
有关碰撞理论,下列说法中正确的是 ( )
A.具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应
B.增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大
C.升温能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能,从而只影响反应速率不影响化学平衡
难度: 中等查看答案及解析
-
香兰素是重要的香料之一,它可由丁香酚经多步反应合成:
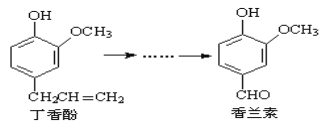
有关上述两种化合物的说法正确的是( )
A. 常温下,1 mol丁香酚只能与1 mol Br2反应
B. 丁香酚不能与FeCl3溶液发生显色反应
C. 1 mol香兰素最多能与3 mol氢气发生加成反应
D. 香兰素分子中至少有12个原子共平面
难度: 困难查看答案及解析
-
科学家最近在-100 ℃的低温下合成了一种烃X,红外光谱和核磁共振氢谱表明其分子中的氢原子所处的化学环境没有区别,根据分析,绘制了该分子的球棍模型如图所示。下列说法中不正确的是( )
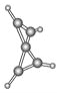
A. 该分子的分子式为C5H4
B. 该分子中碳原子的化学环境有2种
C. 该分子中的氢原子分布在两个相互垂直的平面上
D. 该分子中只有C—C键,没有
键
难度: 困难查看答案及解析
-
化合物丙由如下反应制得:
 。丙的结构简式不可能的是( )
。丙的结构简式不可能的是( )A.CH3CH2CHBrCH2Br B.CH3CH(CH2Br)2 C.CH3CHBrCHBrCH3 D.(CH3)2CBrCH2Br
难度: 中等查看答案及解析
-
下列物质存在顺反异构的是( )
A.乙烷 B.乙烯 C.2-丁烯 D.乙炔
难度: 中等查看答案及解析
-
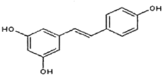 广泛存在于食物(如桑椹,花生,尤其是葡萄)中,具有抗癌性能够它可能跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
广泛存在于食物(如桑椹,花生,尤其是葡萄)中,具有抗癌性能够它可能跟1mol该化合物起反应的Br2或H2的最大用量分别是( )A.1mol,1mol B.3.5mol,7mol
C.3.5mol,6mol D.6mol,7mol
难度: 中等查看答案及解析
-
把3g甲醛气体溶于6g冰醋酸中,再加入4g果糖得混合液甲;另取5g甲酸甲酯和9g葡萄糖相混合得混合液乙;然后将甲和乙两种混合液再按7:4的质量比混合得丙。丙中碳元素的质量分数是( )
A.20% B.35% C.40% D.55%
难度: 简单查看答案及解析