-
下列说法不正确的是
A.聚氯乙烯可以制食物保鲜膜 B.铝热反应可用于焊接钢轨
C.液氯可以保存在钢瓶中 D.常温下可用铁槽车运输浓硫酸
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,7.8gNa2S固体和7.8gNa2O2固体中含有的阴离子数目均为0.1NA
B.在标准状况下,22.4LCl2和HCl的混合气体中含有的分子总数为2×6.02×1023
C.含1molFeCl3的饱和溶液滴入沸水中得到胶体数目为NA
D.标准状况下,Na2O2与足量的CO2反应生成2.24LO2,转移电子数为0.4NA
难度: 中等查看答案及解析
-
某有机物分子中含有羟基,不考虑羟基与氯原子连在同一个碳原子上的情况,分子式为 C4H9ClO的有机物的同分异构体共有
A. 8种 B. 9种 C. 10种 D. 12种
难度: 中等查看答案及解析
-
2019年诺贝尔化学奖花落锂离子电池,美英日三名科学家获奖,他们创造了一个可充电的世界。像高能LiFePO4电池,多应用于公共交通。电池中间是聚合物的隔膜,主要作用是在反应过程中只让Li+通过。结构如图所示。
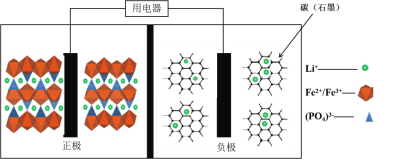
原理如下:(1−x)LiFePO4+xFePO4+LixCn
LiFePO4+nC。下列说法不正确的是( )
A.放电时,正极电极反应式:xFePO4+xLi++xe-=xLiFePO4
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阴极电极反应式:xLi++xe-+nC=LixCn
D.充电时,Li+向左移动
难度: 困难查看答案及解析
-
工业上常用铁碳混合物处理含Cu2+废水获得金属铜。当保持铁屑和活性炭总质量不变时,测得废水中Cu2+浓度在不同铁碳质量比(x)条件下随时间变化的曲线如下图所示。
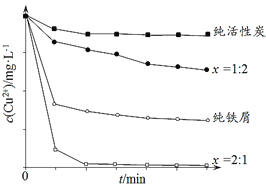
下列推论不合理的是
A.活性炭对Cu2+具有一定的吸附作用
B.铁屑和活性炭会在溶液中形成微电池,铁为负极
C.增大铁碳混合物中铁碳比(x),一定会提高废水中Cu2+的去除速率
D.利用铁碳混合物回收含Cu2+废水中铜的反应原理:Fe+Cu2+=Fe2++Cu
难度: 中等查看答案及解析
-
乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g)
C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。下列分析不正确的是( )
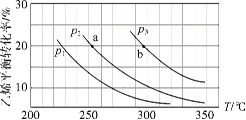
A.乙烯气相直接水合反应的∆H<0
B.图中压强的大小关系为:p1>p2>p3
C.图中a点对应的平衡常数K =
D.达到平衡状态a、b所需要的时间:a>b
难度: 中等查看答案及解析



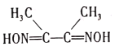 )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。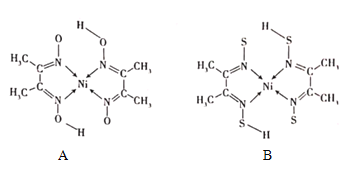
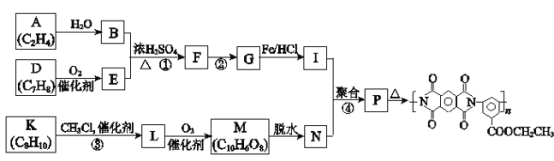

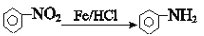
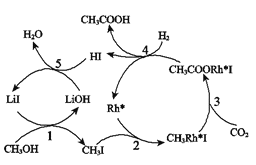
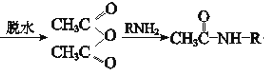 +CH3COOH(R代表烃基)
+CH3COOH(R代表烃基)