-
化学与生活、科技、医药、工业生产均密切相关,下列有关化学叙述正确的是( )
A. 浓硫酸具有强腐蚀性,可用浓硫酸刻蚀石英制艺术品
B. 我国预计2020年发射首颗火星探测器太阳能电池帆板的材料是二氧化硅
C. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色反应
D. 误食重金属盐引起的人体中毒,可喝大量的食盐水解毒
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温下l LpH=7的1mol/LCH3COONH4溶液中CH3COO-与NH4+数目均为NA
B.18.0g葡萄糖和果糖的混合物中含羟基数目为0.5NA
C.1molNa与足量O2反应,生成Na2O和Na2O2的混合物,Na失去2NA个电子
D.室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
难度: 中等查看答案及解析
-
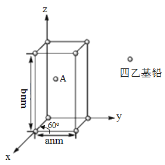
短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、 m、n分别是元素W、X、Y、Z的气体单质,p和 s均为有色气体,v的水溶液呈碱性。常温下,0.1 mol • L -1t 溶液与 0.1 mol • L -1 u 溶液的pH均为1。下列说法不正确的是
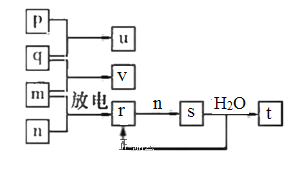
A.Y、W的最高价氧化物对应的水化物均为强酸
B.Z和Y的简单氢化物的稳定性和沸点高低均为:Z>Y
C.s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D.v的电子式可表示为
难度: 中等查看答案及解析
-
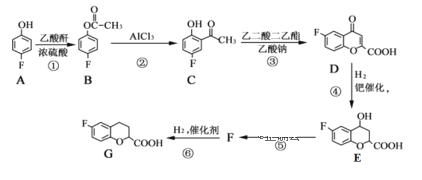
下列关于有机物的说法正确的是
A.乙醇和丙三醇互为同系物
B.二环己烷(
)的二氯代物有7种结构(不考虑立体异构)
C.按系统命名法,化合物
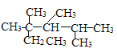 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷D.环己烯(
)分子中的所有碳原子共面
难度: 中等查看答案及解析
-
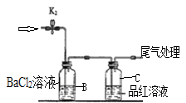
如图是一种综合处理SO2废气的工艺流程。下列说法正确的是

A.溶液酸性:A>B>C
B.溶液B转化为溶液C发生反应的离子方程式为4H++2Fe2++O2 =2Fe3++2H2O
C.向B溶液中滴加KSCN溶液,溶液可能会变为红色
D.加氧化亚铁可以使溶液C转化为溶液A
难度: 中等查看答案及解析
-
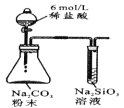
常温下,用AgNO3溶液分别滴定浓度均为0.01 mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解)。下列叙述正确的是( )
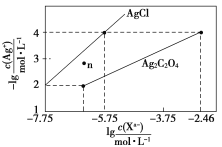
A.Ksp(Ag2C2O4)的数量级等于10-11
B.n点表示AgCl的不饱和溶液
C.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4+2Cl-=2AgCl+C2O42-的平衡常数为109.04
难度: 中等查看答案及解析



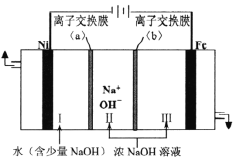
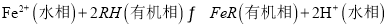 。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为______。在___________(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。