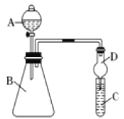
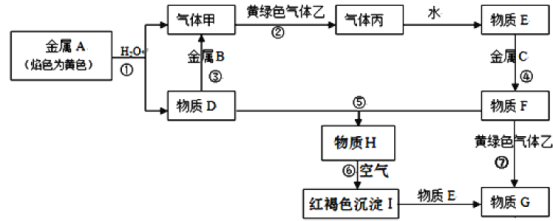
-
在元素周期表中位于金属和非金属元素交界处最容易找到的材料是( )
A.半导体材料 B.制催化剂的材料
C.制农药的材料 D.耐高温、耐腐蚀的合金材料
难度: 简单查看答案及解析
-
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
A.取a克混合物与稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
B.取a克混合物与稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物充分加热,减重b克
D.取a克混合物与Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
难度: 中等查看答案及解析
-
化学与生活、生产密切相关。下列叙述错误的是
A.铝合金大量用于高铁建设 B.考古时利用14C测定一些文物的年代
C.漂粉精可用作游泳池等场所的消毒剂 D.氧化钠可在呼吸面具或潜水艇中作为氧气的来源
难度: 中等查看答案及解析
-
2019年7月中旬,习近平总书记在内蒙古考察并指导开展“不忘初心、牢记使命”主题教育时指出,要继续完善农村公共基础设施,改善农村人居环境,把乡村建设得更加美丽。下列做法不符合上述精神的是
A.做好垃圾污水治理 B.进行厕所革命 C.提升村容村貌 D.大量焚烧田间秸秆
难度: 简单查看答案及解析
-
金属钠着火时,适用于灭火的是
A.水 B.煤油 C.泡沫灭火器 D.干燥沙土
难度: 中等查看答案及解析
-
下列过程包含化学变化的是
A.高炉炼铁 B.氯气液化 C.碘的升华 D.积雪融化
难度: 简单查看答案及解析
-
下列表格中各项分类都正确的一组是类别
类别
选项
酸
碱
酸性氧化物
碱性氧化物
A
H2SO4
Na2CO3
SO2
CaO
B
NaHSO4
NaOH
CO
Na2O
C
HNO3
Ca(OH)2
SO3
Al2O3
D
HClO4
Ba(OH)2
CO2
Fe2O3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列行为不符合安全要求的是
A.点燃甲烷(CH4)前,必须检验气体的纯度
B.大量氯气泄漏时,迅速离开现场并尽量往低处去
C.做实验剩余的金属钠,没有丢弃在废液缸中而放回原试剂瓶中
D.稀释浓硫酸时,将浓硫酸沿器壁缓慢注入水中并不断搅拌
难度: 中等查看答案及解析
-
某澄清透明的溶液中,能大量共存的离子组是
A.Ca2+、K+、OH-、Cl- B.Fe2+、H+、SO42-、NO3-
C.Cu2+、Na+、NO3-、SO42- D.Fe3+、Na+、SO42-、I-
难度: 中等查看答案及解析
-
下列变化没有发生电子转移的是
A.MnO4-→Mn2+ B.Cl2→ClO3- C.Fe(OH)3→Fe2O3 D.FeO→Fe3O4
难度: 简单查看答案及解析
-
实验室常利用反应:NaNO2+NH4Cl
NaCl+N2↑+2H2O制取少量氮气,下列关于该反应的说法不正确的是
A.N2既是氧化产物,又是还原产物
B.NH4Cl中氮元素被还原
C.被氧化的氮原子与被还原的氮原子的物质的量之比为1:1
D.每生成1 mol N2时,转移电子为3 mol
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.将稀硫酸滴在铁片上:2Fe+6H+=2Fe3++3H2↑
B.纯碱与足量稀盐酸反应:HCO3-+H+=H2O+CO2↑
C.用铝粉和NaOH溶液反应制取少量H2:Al+2OH-=AlO2-+H2↑
D.实验室制取CO2:CaCO3+2H+=Ca2++H2O+CO2↑
难度: 中等查看答案及解析
-
下列实验方法正确的是
A.用丁达尔效应鉴别颜色相似的溴水和Fe(OH)3胶体
B.用KSCN溶液检验Fe2(SO4)3溶液中是否含有Fe2+
C.用等浓度的石灰水鉴别Na2CO3和NaHCO3溶液
D.用AgNO3溶液即可检验Cl-
难度: 中等查看答案及解析
-
下列排序不正确的是
A.单质的熔点:钾<铷<铯
B.离子半径:S2->Na+>Mg2+
C.热稳定性:HF>H2O>H2S
D.酸性:H2SiO3<H3PO4<H2SO4
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A. 中子数为10的氧原子:
B. Mg2+的结构示意图:
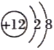
C. 硫化钠的电子式:
D. HCl的形成过程:
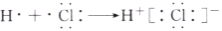
难度: 中等查看答案及解析
-
下列说法正确的是
A.氯化钠溶液在电流的作用下电离成钠离子和氯离子
B.Cl2的水溶液能导电,但Cl2是非电解质
C.盐酸能导电,故盐酸是电解质
D.硫酸钡难溶于水,但硫酸钡是电解质
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.1 mol/L的BaCl2溶液中含Cl-的数目为2NA
B.常温常压下,28 g N2中所含电子数目为10NA
C.标准状况下,4.48 L CH4中所含原子数目为NA
D.2 mol Al与足量盐酸完全反应,转移电子数目为3NA
难度: 中等查看答案及解析
-
下列说法正确的是
A.同温、同压下,相同质量的气体都占有相同的体积
B.同温、同压下,相同体积的气体都含有相同数目的分子
C.气体摩尔体积约为22.4 L/mol,一定是在标准状况下
D.18 g H2O在标准状况下的体积约为22.4 L
难度: 中等查看答案及解析
-
浓度为0.1 mol/L的HCl溶液V mL,加水稀释到2V mL,再取出10 mL,这10 mL溶液中c(H+)为
A.0.1 mol/L B.0.01 mol/L C.0.02 mol/L D.0.05 mol/L
难度: 中等查看答案及解析
-
将3.9 g 镁铝合金投入到足量的NaOH溶液中,共产生标准状况下H2的体积为3.36 L。则原合金中镁和铝的物质的量之比是
A.1:1 B.1:2 C.1:3 D.2:3
难度: 中等查看答案及解析
-
下列实验过程可以达到实验目的的是编号实验目的实验过程
编号
实验目的
实验过程
A
制备Fe(OH)3胶体
将NaOH溶液滴加到饱和FeCl3溶液中
B
探究维生素C的还原性
向盛有2 mL黄色FeCl3溶液的试管中滴加浓的维生素C溶液,观察颜色变化
C
制取并纯化氯气
向MnO2中加入浓盐酸并加热,将生成的气体依次通过浓硫酸、饱和食盐水
D
证明某盐溶液中含有Na+不含K+
用洁净的铂丝蘸取待检液,在无色火焰上灼烧,观察到火焰呈黄色
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
反应3NO2+H2O===2HNO3+NO中,当有6 mol e-发生转移时,被氧化的物质与被还原的物质的物质的量之比为( )
A.1∶1 B.1∶2 C.2∶1 D.3∶1
难度: 中等查看答案及解析
-
有下列离子反应:
①Fe3++Cu=Fe2++Cu2+ ②2Na+2H2O=2Na++2OH-+H2↑
③Ag++Cl-=AgCl↓ ④Fe+Fe3+=2Fe2+
⑤2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O ⑥Al2O3+2OH-=2AlO2-+H2↑,
其中属于氧化还原反应且书写正确的是
A.①②④⑥ B.①②④ C.② D.③⑤
难度: 中等查看答案及解析
-
X、Y、Z均为短周期元素,其简单离子X+、Y3+、Z2-的核外电子层结构相同。下列说法不正确的是
A.原子序数:Y>X>Z B.原子半径:Z>X>Y
C.单质的还原性:X>Y D.碱性:XOH>Y(OH)3
难度: 中等查看答案及解析
-
短周期中三种元素a、b、c在周期表中的位置如图,下列有关这三种元素的叙述正确的是( )
A.a是一种活泼的非金属元素
B.c的最高价氧化物的水化物是一种弱酸
C.b的氢化物很稳定
D.b元素的最高化合价为+7价
难度: 简单查看答案及解析
-
下列实验中的颜色变化,与氧化还原反应无关的是编号实验现象
编号
实验
现象
A
NaOH溶液滴入FeSO4溶液中
产生白色沉淀,随后变为红褐色
B
石蕊溶液滴入氯水中
溶液变红,随后迅速褪色
C
Na2O2在空气中放置
由淡黄色变为白色
D
澄清的石灰水在空气中久置
出现白色固体
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列各组的两个量,前者不恰好是后者二倍的是
A.Na2O2中阳离子和阴离子的个数
B.Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O反应中,反应的HNO3的物质的量和被还原的HNO3的物质的量
C.质量分数为98%的H2SO4的物质的量浓度和质量分数为49%的H2SO4的物质的量浓度
D.分别发生KMnO4受热分解、MnO2催化H2O2分解反应,当得到同温同压下同体积O2时,两个反应转移的电子数
难度: 中等查看答案及解析
-
下列化学方程式中,不能正确表达反应颜色变化原因的是
A.向FeCl3溶液中滴加几滴KSCN溶液,变成红色:FeCl3+3KSCN=Fe(SCN)3↓+3KCl
B.向新制的KI溶液中滴加几滴溴水,振荡,再滴加淀粉溶液,溶液显蓝色:2KI+Br2=I2+2KBr
C.向CuSO4溶液中加入足量Zn粉,溶液蓝色消失:Zn+CuSO4=Cu+ZnSO4
D.向CuSO4溶液中滴加NaOH溶液,产生蓝色沉淀:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
难度: 中等查看答案及解析
-
a、b、c、d均为短周期元素,a的原子中只有1个电子,b2-和c+离子的电子层结构相同,d的原子L层有4个电子。下列叙述正确的是
A.a分别与b、c、d形成的二元化合物中a的化合价均为+1
B.b与其他三种元素均可形成至少两种二元化合物
C.a与b形成的化合物中一定只有极性键,b与c形成的化合物中一定只有离子键
D.原子半径大小顺序c>b>d>a
难度: 中等查看答案及解析
-
根据下列表中信息,下列叙述正确的是
短周期元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.089
0.102
0.074
元素最高正价或最低负价
+2
+3
+2
+6、-2
-2
A.T2和T3互为同位素
B.单质与稀盐酸反应的速率:L<Q
C.M与T形成的化合物既能与强酸反应,又能与强碱反应
D.氢化物H2T与H2R均为含10个电子的分子
难度: 中等查看答案及解析