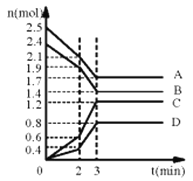
-
下列各组物质的熔点均与所含化学键的键能有关的是
A. CaO与CO2 B. NaCl与HCl C. SiC与SiO2 D. Cl2与I2
难度: 中等查看答案及解析
-
下列有关杂化轨道的叙述错误的是 ( )
A.并不是所有的原子轨道都参与杂化
B.同一个原子中能量相近的原子轨道参与杂化
C.杂化轨道能量集中,有利于牢固成键
D.杂化轨道中一定有电子
难度: 简单查看答案及解析
-
下列过程中,需要吸收能量的是( )
A.H+H=H2 B.S+O2=SO2 C.I2=I+I D.H++OH-=H2O
难度: 简单查看答案及解析
-
下列反应属于可逆反应的是( )
A.Cl2与水的反应
B.氮气和氧气的反应
C.电解水生成H2和O2,点燃H2和O2的混合物生成H2O
D.甲烷和氯气光照发生的反应
难度: 简单查看答案及解析
-
下列基态原子的价电子排布式中,正确的是
A.3d94s2 B.3d44s2 C.3d104s0 D.3d84s2
难度: 简单查看答案及解析
-
不能够支持石墨是晶体这一事实的选项是( )
A.石墨和金刚石是同素异形体 B.石墨中的碳原子呈周期性有序排列
C.石墨的熔点为3625℃ D.在石墨的X-射线衍射图谱上有明锐的谱线
难度: 简单查看答案及解析
-
下列晶体性质的比较中错误的是
A.熔点:金刚石>碳化硅>晶体硅 B.沸点:NH3>PH3
C.硬度:白磷>冰>二氧化硅 D.熔点:SiI4>SiBr4>SiCl4
难度: 中等查看答案及解析
-
对某一可逆反应来说,使用催化剂的作用是( )
A.提高反应物的平衡转化率 B.以同样程度改变正、逆反应速率
C.增大反应的活化能 D.改变平衡混合物的组成
难度: 中等查看答案及解析
-
下列反应既是氧化还原反应,又是放热反应的是( )
A.铝片与稀H2SO4反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与CO2反应
D.NaOH与HCl反应
难度: 简单查看答案及解析
-
甲烷晶体的晶胞结构如图所示,下列说法正确的是( )
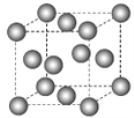
A.甲烷晶胞中的球只代表1个C原子
B.晶体中1个CH4分子周围有12个紧邻的CH4分子
C.甲烷晶体熔化时需克服共价键
D.1个CH4晶胞中含有8个CH4分子
难度: 简单查看答案及解析
-
下列各组物质中,化学键类型都相同的是( )
A.CaCl2和NaOH B.Na2O和Na2O2 C.CO2和CS2 D.[Cu(NH3)4]SO4和NaCl
难度: 中等查看答案及解析
-
下列物质由极性键和非极性键构成的非极性分子是( )
A.NaCl B.CH4 C.C2H5OH D.C2H4
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.对于有气体参加的可逆反应,加压化学平衡不一定发生移动
B.外界条件的改变引起v正≠v逆,则平衡一定发生移动
C.平衡移动,反应物的浓度一定减小
D.外界条件发生变化,化学平衡不一定移动
难度: 简单查看答案及解析
-
对于反应:I2(g)+H2(g)⇌2HI(g),在密闭容器中进行,下列条件能加快化学反应速率的是( )
A.缩小体积使压强增大 B.体积不变充入He使气体压强增大
C.体积不变使压强减小 D.使总压强不变,充入Ne
难度: 中等查看答案及解析
-
已知葡萄糖(C6H12O6)的燃烧热是2804kJ·mol-1,当它在人体内氧化生成1g水时放出的热量约为( )
A.26.0kJ B.51.9kJ C.155.8kJ D.467.3kJ
难度: 中等查看答案及解析
-
下列事实,不能用勒夏特列原理解释的是( )
A.氨水中加酸,NH4+的浓度增大
B.合成氨工业中不断从反应混合物中液化分离出氨气
C.实验室中常用排饱和食盐水的方法收集Cl2
D.合成氨控制在500℃左右的温度而不用室温
难度: 中等查看答案及解析
-
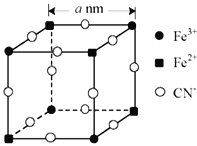
已知氯化铬的水合物为CrCl3·6H2O,其中铬元素的配位数是6,将含0.1 mol氯化铬的水溶液用过量稀硝酸银溶液处理时,只得到0.2 mol AgCl沉淀,则氯化铬溶于水中的含铬阳离子为
A. Cr3+ B. [CrCl2(H2O)4]+ C. [CrCl(H2O)5]2+ D. [Cr(H2O)6]3+
难度: 中等查看答案及解析
-
已知:HCN(aq)与NaOH(aq)反应生成1mol水的ΔH=-12.1kJ·mol-1;HCl(aq)与NaOH(aq)反应生成1mol水的ΔH=-55.6kJ·mol-1,则HCN在水溶液中电离的ΔH等于( )
A.-67.7kJ·mol-1 B.-43.5kJ·mol-1 C.+43.5kJ·mol-1 D.+67.7kJ·mol-1
难度: 中等查看答案及解析
-
对于可逆反应:2SO2(g)+O2(g)
2SO3(g),下列措施能使反应中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A.增大压强 B.升高温度 C.使用催化剂 D.多充入O2
难度: 中等查看答案及解析
-
如图所示是从NaCl或CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( )
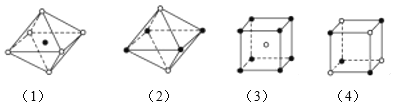
A.(1)和(3) B.(2)和(3) C.(1)和(4) D.只有(4)
难度: 简单查看答案及解析