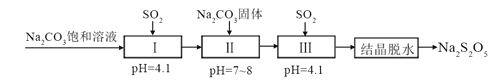
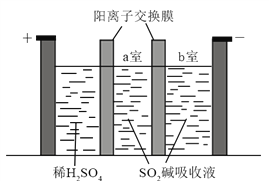
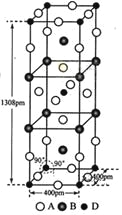
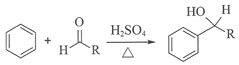
-
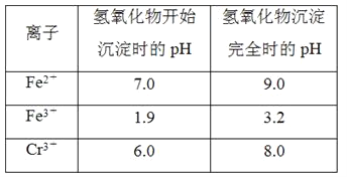
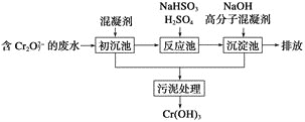
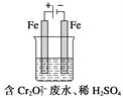
短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于I A族,W与X属于同一主族。下列说法正确的是
A. 元素X、W的简单阴离子具有相同的电子层结构
B. 由Y、Z两种元素组成的化合物是离子化合物
C. W的简单气态氢化物的热稳定性比Y的强
D. 原子半径:r(X)<r(Y)<r(Z)<r(W)
难度: 中等查看答案及解析
-
下列叙述不正确的是
A.金属腐蚀的本质是金属原子失去电子而被氧化
B.钢铁吸氧腐蚀的正极反应是:O2+4e-+2H2O=4OH-
C.氢氧燃料电池中,氢气在负极发生氧化反应
D.将地下钢管与直流电源的正极相连,用来保护钢管
难度: 中等查看答案及解析
-
下列有关实验的说法不正确的是( )
A.测定中和热实验的玻璃仪器只需烧杯、量筒和温度计
B.用25mL碱式滴定管量取13.50mLNa2CO3溶液
C.用10mL量筒量取5.5mL硫酸溶液
D.用广泛pH试纸测得某碱溶液的pH为12
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.钠与水反应:Na +2H2O=Na++2OH–+H2↑
B.电解饱和食盐水获取烧碱和氯气:2Cl–+2H2O
H2↑+Cl2↑+2OH–
C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH–+H++SO42-=BaSO4↓+H2O
D.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH–=CaCO3↓+H2O
难度: 中等查看答案及解析
-
某固体物质只含有钠和氧两种元素,将它放在足量的水中产生两种气体,这两种气体又可以在一定条件下反应生成水。则原固体物质的组成是 ( )
A.Na2O2与Na2O B.Na和NaOH C.Na2O2和Na D.Na和Na2O
难度: 中等查看答案及解析
-
以下根据实验现象的推断,正确的是
A.能使润湿的碘化钾淀粉试纸变蓝的气体一定是Cl2
B.能使澄清石灰水变浑浊的无色气体一定是CO2
C.在潮湿空气中能形成白雾的气态氢化物一定是HCl
D.溶于水能形成无色溶液的红棕色气体一定是NO2
难度: 中等查看答案及解析
-
某有机物的键线式如图所示,下列关于该有机物的描述不正确的是
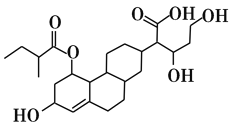
A.含有4种官能团
B.能发生取代、加成、酯化、氧化、还原等反应
C.1mol该物质最多可与3molH2发生加成反应
D.该有机物与Na、NaOH、Na2CO3均能反应
难度: 中等查看答案及解析