-
化学与环境、工农业生产等密切相关,下列说法不正确的是( )
A.NaCl不能使蛋白质变性,所以不能用作食品防腐剂
B.浸有酸性高锰酸钾溶液的硅藻土可用于水果保鲜
C.捕获工业排放的CO2,可用来合成可降解塑料聚碳酸酯
D.在葡萄酒中添加微量SO2作抗氧化剂,可使酒保持良好品质
难度: 简单查看答案及解析
-
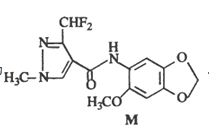
2018年我国首次合成了在有机化工领城具有重要价值的化合物M(结构简式如图所示)。下列关于M的说法错误的是( )
A.分子式为C10H11NO5
B.所有碳原子可以处在同一平面内
C.能发生取代反应和加成反应
D.苯环上的氢原子被两个氯原子取代的结构有4种(不考虑立体结构)
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。(离子可以看作是带电的原子)下列叙述正确的是( )
A.标准状况下,22.4 L SO3中所含的分子数为NA
B.0.1 mol•L-1的Na2CO3溶液中,CO32-的数目小于0.1NA
C.8.0g由Cu2S和CuO组成的混合物中,所含铜原子的数目为0.1NA
D.标准状况下,将2.24L Cl2通入水中,转移电子的数目为0.1NA
难度: 中等查看答案及解析
-
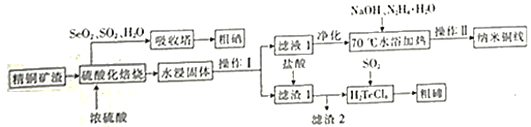
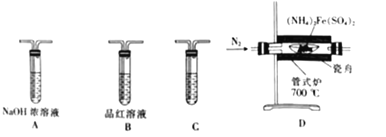
氯气氧化HBr提取溴的新工艺反应之一为:6H2SO4+5BaBr2+Ba(BrO3)2=6BaSO4↓+6Br2+6H2O,利用此反应和CCl4得到液溴的实验中不需要用到的实验装置是
A.
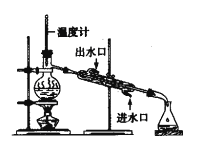
B.
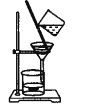
C.
D.
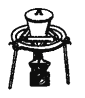
难度: 中等查看答案及解析
-
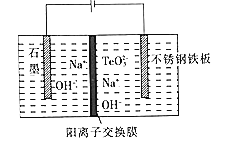
用H2消除酸性废水中的NO2-是一种常 用的电化学方法。其反应原理如图所示,下列说法不正确的是( )
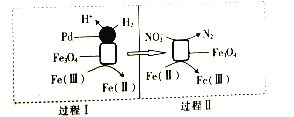
A.Fe3O4在该反应中作催化剂
B.Pd上发生的反应为H2-2e-═2H+
C.总反应为3H2+2NO2-═N2+2OH-+2H2O
D.Fe(Ⅱ)与Fe(Ⅲ)之间相互转化起到了传递电子的作用
难度: 中等查看答案及解析
-
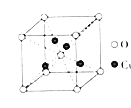
短周期主族元素X、Y、Z、W的原子序数依次增大,它们能组成一种化合物,其结构如图所示。下列说法正确的是
A.最高价氧化物对应水化物的酸性:Y>X
B.原子半径:Z>W>Y>X
C.W与Z形成的化合物Z2W2中只含离子键
D.W的单质难溶于W与X形成的化合物XW2
难度: 简单查看答案及解析
-
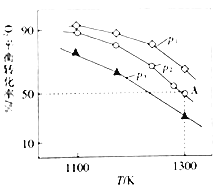
甲胺(CH3NH2)的性质与氨气相似,将pOH相同、体积均为V0的CH3NH2•H2O和NaOH两种溶液分别加水稀释至体积为V,pOH随lg V/V0的变化关系如图所示,下列叙述错误的是( )
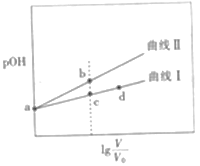
已知:常温下,pH+pOH=14.pOH=-lgc(OH-)
A.稀释相同倍数时,CH3NH2•H2O的浓度比NaOH的浓度大
B.溶液中水的电离程度:b点大于c点
C.由c点到d点,溶液中
保持不变
D.常温下,某盐酸的pH=m,a点时CH3NH2•H2O的pH=n,当m+n=14时,取等体积的两溶液混合,充分反应后:n(Cl-)>n(CH3NH3+)>n(H+)>n(OH-)
难度: 困难查看答案及解析