-
下列溶液一定呈中性的是( )
A.pH=7的溶液 B.c(H+)=c(OH-)的溶液
C.由强酸、强碱等物质的量反应得到的溶液 D.非电解质溶于水得到的溶液
难度: 中等查看答案及解析
-
下列有关问题,与盐的水解有关的是( )
① NH4Cl 与 ZnCl2 溶液可作焊接金属中的除锈剂
②用 NaHCO3 与 Al2(SO4)3 两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干 AlCl3 溶液得到 Al(OH)3 固体
A.①②③④⑤ B.②③④ C.①④⑤ D.①②③
难度: 中等查看答案及解析
-
准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.1000 mol·L-1 NaOH溶液滴定。下列说法正确的是
A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
难度: 简单查看答案及解析
-
为了除去CuCl2酸性溶液中的Fe3+,可在加热条件下加入一种试剂,该试剂是
A.氢氧化钠 B.硫酸 C.氧化铜 D.氨水
难度: 简单查看答案及解析
-
常温下1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( )
A.9.0 B.9.5 C.1 0.5 D.1 1.0
难度: 中等查看答案及解析
-
室温下,下列溶液中粒子浓度关系正确的是
A.
溶液:
B.
溶液:
C.
溶液:
D.
和
混合溶液:
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.弱酸酸式盐NaHB在水溶液中水【解析】
HB–+H2OH3O++B2–
B.硫化钠水【解析】
S2- + 2H2O = H2S↑+2OH-C.碳酸钠溶液显碱性:CO32-+H2O
HCO3-+OH-
D.制备氢氧化铁胶体:Fe3+ +3H2O
Fe(OH)3(胶体) + 3H+
难度: 中等查看答案及解析
-
关于某酸的酸式盐NaHY的水溶液的下列叙述中,正确的是
A.该酸式盐的水溶液一定显酸性
B.在该盐溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C.若HY-能水解,水解方程式为:HY-+H2O
Y2-+H3O+
D.若HY-能电离,电离方程式为:HY-+H2O
Y2-+H3O+
难度: 中等查看答案及解析
-
将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
A.c(H+) B.Ka(HF) C.
D.
难度: 中等查看答案及解析
-
25℃时,在等体积的①pH=0的H2SO4溶液,②0.05 mol/L的Ba(OH)2溶液③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
室温下,在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是
① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3-
A.③⑤ B.①③⑤ C.①③ D.②④⑤
难度: 中等查看答案及解析
-
实验室现有3种酸碱指示剂,其pH的变色范围如下:甲基橙:3.1~4.4、石蕊:5.0~8.0、酚酞:8.2~10.0。用0.1000 mol/LNaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述正确的是( )
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
难度: 中等查看答案及解析
-
25℃时有三瓶溶液: pH=3的盐酸、pH=3的醋酸溶液和pH=11的氢氧化钠溶液,下列说法正确的是( )
A.中和等体积的pH=11的氢氧化钠溶液,所需pH=3的醋酸溶液的体积大于pH=3的盐酸的体积
B.往上述盐酸、醋酸溶液中分别加入少量相同的锌粒,盐酸中的锌粒先反应完全
C.将上述醋酸溶液、氢氧化钠溶液混合得到pH=7的溶液,该溶液中c(Na+)大于c(CH3COO-)
D.25℃时pH=3的盐酸、pH=11的NaOH溶液中水电离出的c(H+)均为10-11 mol/L
难度: 中等查看答案及解析
-
25℃时向20 mL 0.1 mol/L醋酸溶液中不断滴入0.1 mol/LNaOH溶液,溶液pH变化如图所示。此过程里溶液中离子浓度的关系错误的是( )
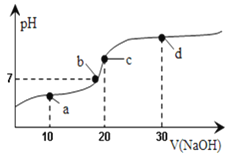
A.a点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.b点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C.c点:c(H+)=c(CH3COOH)+c(OH-)
D.d点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
室温条件下,现有四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列有关说法正确的是
A.等体积的①④混合后,c(Na+)>c(CH3COO-)
B.将②、③溶液混合后,pH=7,消耗溶液的体积:③=②
C.等体积的①、②、④溶液分别与足量铝粉反应,②生成的H2的物质的量最大
D.由水电离出的c(H+):①=②=③=④
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.95℃纯水显中性,故pH=7
B.稀释弱电解质溶液时,溶液中所有粒子浓度都减小
C.pH试纸在使用之前应用蒸馏水润湿
D.室温下,向10 mL pH=3的醋酸溶液中加水稀释后,溶液中
的值不变
难度: 中等查看答案及解析
-
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号
起始浓度/(mol·L-1)
反应后溶液的pH
c(HA)
c(KOH)
①
0.1
0.1
9
②
x
0.2
7
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
难度: 简单查看答案及解析
-
改变0.1
二元弱酸
溶液的pH,溶液中的
、
、
的物质的量分数
随pH的变化如图所示[已知
]。
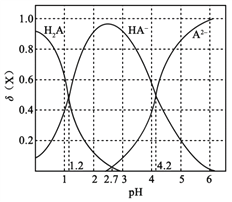
下列叙述错误的是
A. pH=1.2时,
B.
C. pH=2.7时,
D. pH=4.2时,
难度: 困难查看答案及解析
-
甲、乙两醋酸稀溶液,甲的pH=a,乙的pH=a+1,下列判断正确的是( )
A.甲中由水电离出来的H+的物质的量浓度是乙的
B.甲、乙两溶液物质的量浓度之间的关系:c(甲)=10c(乙)
C.用甲、乙分别中和含有等物质的量的NaOH溶液, 两者的体积(V)之间的关系为10V(甲)>V(乙)
D.甲中的c(OH-)为乙中的c(OH-)的10倍
难度: 中等查看答案及解析
-
25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是
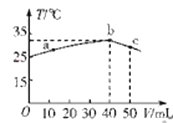
A.HA溶液的物质的量浓度为0.0l mol·L-1
B.b→c的过程中,温度降低的原因是溶液中发生了吸热反应
C.a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+)
D.25℃时,HA的电离平衡常数K约为1.43×10-2
难度: 中等查看答案及解析