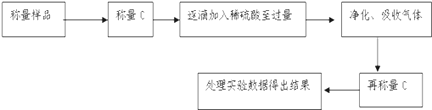
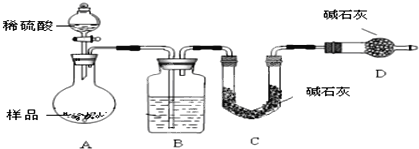
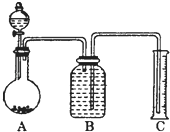
-
用NA表示阿伏加德罗常数,下列叙述正确的是
A.标准状况下,22.4L H2O含有的分子数为1NA
B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA
C.通常状况下,1NA个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA
难度: 中等查看答案及解析
-
下列各项中所列举的物质与所属类别对应不正确的是( )
A.化合物:干冰,冰水混合物,烧碱,小苏打
B.非电解质:乙醇,四氯化碳,氯气,葡萄糖
C.同素异形体:活性炭,C60,石墨烯,金刚石
D.混合物:铝热剂,纯净矿泉水,盐酸,漂白粉
难度: 中等查看答案及解析
-
下列各组离子在强碱性条件下能大量共存,且在强酸性条件下能发生氧化还原反应的是( )
A.Mg2+、Na+、SO42−、Cl− B.K+、CO32−、Cl−、NO3−
C.K+、Ba2+、I−、NO3− D.SO32−、NO3−、Na+、NH4+
难度: 简单查看答案及解析
-
配制一定物质的量浓度的盐酸溶液时,下列操作可使所配制溶液浓度偏高的是( )
A.用量筒量取浓盐酸俯视读数 B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线 D.摇匀后见液面下降,再加水至刻度线
难度: 简单查看答案及解析
-
下列说法正确的是
①氯气的性质活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
③新制氯水的氧化性强于久置氯水
④检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液
⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水中
A.①②③ B.③ C.②③④ D.③⑤
难度: 中等查看答案及解析
-
为检验某固体物质中是否铵盐,你认为下列试纸或试剂一定用不到的是( )
①蒸馏水 ②氢氧化钠溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸
A.①⑤ B.④⑤ C.①③ D.①④⑤
难度: 中等查看答案及解析
-
根据所给的信息和标志,判断下列说法错误的是( )
A
B
C
D
《神农本草经》记载,麻黄能“止咳逆上气”
碳酸氢钠药片


古代中国人已用麻黄治疗咳嗽
该药是抗酸药,服用时喝些醋能提高药效
看到有该标志的丢弃物,应远离并报警
贴有该标志的物品是可回收物
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
选项
陈述Ⅰ
陈述Ⅱ
A
S有可燃性
S在纯氧中燃烧生成SO3
B
SiO2有导电性
SiO2可用于制备光导纤维
C
浓硫酸有强氧化性
浓硫酸可用于干燥H2和CO
D
Fe3+有氧化性
FeCl3溶液可用于回收废旧电路板中的铜
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
B.碳酸氢铵溶液与足量的NaOH溶液混合后加热: NH4++OH-
NH3↑+H2O
C.过量的KHSO4溶液与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-===BaSO4↓+H2O
D.向稀氢氧化钠溶液中通入少量CO2:OH-+CO2===HCO3-
难度: 中等查看答案及解析
-
下列说法正确的是
A.浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸
B.在KI淀粉溶液中通入氯气,溶液变蓝,说明氯气能与淀粉发生显色反应
C.在某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成,说明溶液中一定含SO42-
D.将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化
难度: 中等查看答案及解析
-
某氧化还原反应中有反应物和生成物共六种: NO、FeSO4、Fe(NO3)3、 H2O、 HNO3和 Fe2(SO4)3。其中 HNO3为反应物,则该反应中的还原剂为( )
A. NO B. FeSO4 C. Fe(NO3)3 D. Fe2(SO4)3
难度: 中等查看答案及解析
-
有一瓶无色溶液,可能含有Na+、K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-离子中的几种.为确定其成分,进行如下实验:①取少许溶液,逐渐加入过量的Na2O2固体,产生无色无味的气体和白色沉淀且白色沉淀逐渐增多后又部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生;③用洁净的铂丝蘸取原溶液在酒精灯火焰上灼烧,观察到黄色火焰.下列推断正确的是( )
A.肯定有Na+、Al3+、Mg2+、SO42- B.肯定有Na+、Mg2+、Al3+、Cl-
C.肯定没有K+、HCO3-、MnO4- D.肯定没有K+、NH4+、Cl-
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A.在粗硅的制取中发生2C+SiO2
2CO↑+Si,硅被还原,所以碳的还原性大于硅的还原性
B.硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞试剂瓶中
C.用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D.由Na2CO3+SiO2
CO2↑+Na2SiO3可知硅酸的酸性大于碳酸
难度: 中等查看答案及解析
-
NaCl是一种化工原料,可以制备一系列物质。下列说法正确的是
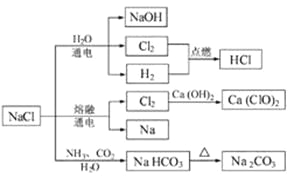
A.25℃,NaHCO3在水中的溶解度比Na2CO3的大
B.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
C.图4所示转化反应都是氧化还原反应
D.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
难度: 中等查看答案及解析
-
下列实验能证明一定有二氧化硫存在的是( )
①能使澄清石灰水变浑浊;
②能使湿润的蓝色石蕊试纸变红;
③能使品红溶液褪色;
④通入足量的氢氧化钠溶液再加BaCl2溶液有白色沉淀产生,该沉淀溶于稀盐酸;
⑤通入气体能使溴水褪色,再滴加Ba(NO3)2溶液有白色沉淀产生。
A.只有⑤ B.均能 C.③④⑤ D.均不能
难度: 中等查看答案及解析
-
VL Fe2(SO4)3溶液中含有ag SO42-,取此溶液0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量的浓度为
A.
mol/L B.
mol/L
C.
mol/L D.
Vmol/L
难度: 中等查看答案及解析
-
两种金属混合物共15 g,投入足量的盐酸中,充分反应后得到11.2 L H2(标准状况),则原混合物的组成肯定不可能为 ( )
A. Mg和Ag B. Zn和Cu
C. Al和Zn D. Al和Cu
难度: 中等查看答案及解析
-
质量分数为a%,物质的量浓度为c1 mol/L的稀硫酸蒸发水后,其质量分数变为2a%,此时物质的量浓度为c2 mol/L,则c1与c2的关系为
A.c2=2c1 B.c2<2c1 C.c2>2c1 D.c1=2c2
难度: 困难查看答案及解析
-
某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量的关系如图所示。
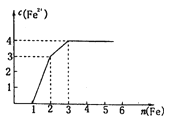
溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
A.1:1:1 B.1:3:1 C.1:1:4 D.3:3:8
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:
。下列有关物质的推断不正确的是
A.若甲为焦炭,则丁可能是O2 B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸 D.若甲为NaOH溶液,则丁可能是CO2
难度: 困难查看答案及解析
-
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500ml 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量为
(已知NO+NO2+2NaOH===2NaNO2+H2O,2NO2+2NaOH===NaNO3+NaNO2+H2O)
A.0.8mol B.0.6mol C.0.2mol D.1.0mol
难度: 中等查看答案及解析