-
下列说法中正确的是
A.糖类化合物都能发生水解
B.氨基酸、淀粉均属于高分子化合物
C.植物油的主要成分是高级脂肪酸
D.蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
难度: 中等查看答案及解析
-
将Na2O2投入FeCl3溶液中,可观察到的现象是 ( )
①生成白色沉淀 ②生成红褐色沉淀 ③有气泡产生
④因为Na2O2具有漂白性,所以FeCl3溶液褪色
A. ①④ B. ②③ C. ①③ D. 仅②
难度: 中等查看答案及解析
-
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
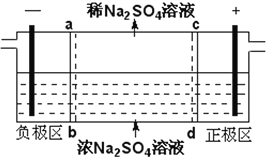
A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
难度: 中等查看答案及解析
-
有关化学用语的表达正确的是( )
A.Na2O2电子式
B.二氧化硅的分子式SiO2
C.乙烯的结构简式CH2CH2 D.硫原子的最外层电子排布式3s23p4
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.CO,NO,NO2都是大气污染气体,在空气中都能稳定存在
B.NO可用于某些疾病的治疗
C.NO2通入FeSO4溶液中始终无明显现象
D.汽车尾气的主要污染成分包括NO、CO和N2
难度: 简单查看答案及解析
-
下列有关物质性质的叙述一定不正确的是
A. 向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
B. KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体
C. NH4Cl与Ca(OH)2混合加热可生成NH3
D. Cu与FeCl3溶液反应可生成CuCl2
难度: 简单查看答案及解析
-
在湿法炼锌的电解循环溶液中,较高浓度的
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去
。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
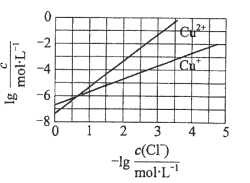
A.
的数量级为
B. 除
反应为Cu+Cu2++2
=2CuCl
C. 加入Cu越多,Cu+浓度越高,除
效果越好
D. 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
难度: 困难查看答案及解析