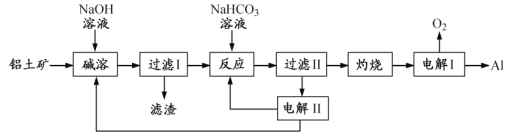
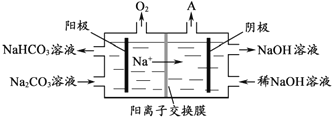
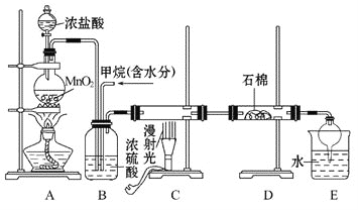
-
a、b、c、d为短周期元素,a的原子中只有1个电子,b2−和C+离子的电子层结构相同,d与b同族。下列叙述错误的是
A.a与其他三种元素形成的二元化合物中其化合价均为+1
B.b与其他三种元素均可形成至少两种二元化合物
C.c的原子半径是这些元素中最大的
D.d和a形成的化合物的溶液呈弱酸性
难度: 中等查看答案及解析
-
下列基本实验操作中,不合理的是
A.分液操作时,分液漏斗下端管口尖端处紧靠烧杯内壁
B.可用湿润的pH试纸检验氨气
C.稀释浓硫酸时,可向盛有浓硫酸的烧杯中直接加蒸馏水
D.试管可用酒精灯直接加热,也可用水浴加热
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是
A.NaHCO3受热易分解,可用于制胃酸中和剂
B.SiO2熔点高硬度大,可用于制光导纤维
C.Al2O3是两性氧化物,可用作耐高温材料
D.CaO能与水反应,可用作食品干燥剂
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A. Fe
FeCl2
Fe(OH)2 B. S
SO3
H2SO4
C. CaCO3
CaO
CaSiO3 D. NH3
NO
HNO3
难度: 中等查看答案及解析
-
在如图所示装置中进行氨的催化氧化实验:往三颈瓶内的浓氨水中不断通入空气,将红热的铂丝插入瓶中并接近液面。反应过程中,可观察到瓶中有红棕色气体产生,铂丝始终保持红热。下列有关说法错误的是( )
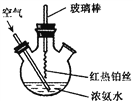
A. 反应后溶液中含有NO3-
B. 反应后溶液中c(H+)增大
C. 实验过程中有化合反应发生
D. 实验过程中NH3•H2O的电离常数不可能发生变化
难度: 中等查看答案及解析
-
全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是

A.电池工作时,正极可发生反应:2Li2S6+2Li++2e−=3Li2S4
B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中Li2S2的量越多
难度: 困难查看答案及解析
-
向某密闭容器中加入0.3molA、0.1molC和一定量B三种气体。一定条件下发生反应,各物质浓度随时间变化如图甲所示[t0~t1阶段c(B)未画出]。图乙为t2时刻后改变条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种条件并且所用条件均不相同。已知t3~t4阶段为使用催化剂。下列说法正确的是 ( )
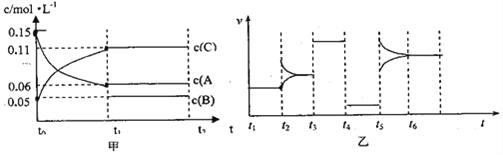
A.若t1等于15s,生成物C在t0~t1时间段的平均反应速率为0.004mol/(L・s)
B.t4~t5阶段改变的条件为降低反应温度
C.B的起始的物质的量为0.02mol
D.t5~t6阶段可能是增大压强
难度: 困难查看答案及解析