-
化学与生产、生活、社会密切相关。下列有关说法中,错误的是
A.利用可降解的“玉米塑料”替代一次性饭盒,可防止产生白色污染
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
D.喝补铁剂时,加服维生素C,效果更好,原因是维生素C具有氧化性
难度: 中等查看答案及解析
-
用NA表示阿伏伽德罗常数,下列说法不正确的是:( )
A.标况下,22.4L的CO和1mol的N2所含电子数相等。
B.1.0L 0.1mol/L的醋酸钠溶液中含CH3COOH、CH3COO—的粒子总数为0.1NA。
C.5.6g铁粉加入足量稀HNO3中,充分反应后,转移电子总数为0.2NA。
D.18.4g甲苯中含有C—H键数为1.6 NA。
难度: 中等查看答案及解析
-
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是
A.原子半径的大小顺序:rY> rX>rQ>rW
B.X、Y的最高价氧化物的水化物之间不能发生反应
C.Z元素的氢化物稳定性大于W元素的氢化物稳定性
D.元素Q和Z能形成QZ2型的共价化合物
难度: 中等查看答案及解析
-
克伦特罗是一种平喘药,但被违法添加在饲料中,俗称“瘦肉精”,其结构简式如图。下列有关“瘦肉精”的说法正确的是
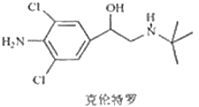
A.它的分子式为C12H17N2Cl2O
B.它含有氨基、氯原子、碳碳双键等官能团
C.1mol克伦特罗最多能和3 molH2发生加成反应
D.一定条件下它能发生水解反应、酯化反应、消去反应、氧化反应、加聚反应等
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.常温下,向醋酸溶液中加入少量的水,溶液中c(H+)将增大
B.常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同
C.向NaHCO3溶液中加入少量的澄清石灰水,所得溶液的pH不变
D.常温下,2NO(g)+2CO(g)═N2(g)+2CO(g)能自发进行,则该反应的△H>0
难度: 简单查看答案及解析
-
下列反应中,相关示意图像错误的是:
A.
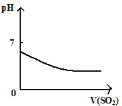 将二氧化硫通入到一定量氯水中
将二氧化硫通入到一定量氯水中B.
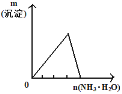 将氨水滴入到一定量氯化铝溶液中
将氨水滴入到一定量氯化铝溶液中C.
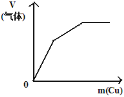 将铜粉加入到一定量浓硝酸中
将铜粉加入到一定量浓硝酸中D.
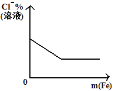 将铁粉加入到一定量氯化铁溶液中
将铁粉加入到一定量氯化铁溶液中难度: 中等查看答案及解析
-
将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是:( )
A.加入合金的质量不可能为6.4g
B.沉淀完全时消耗NaOH溶液的体积为120mL
C.溶解合金时收集到NO气体的体积在标准状况下为2.24L
D.参加反应的硝酸的物质的量为0.2mol
难度: 中等查看答案及解析
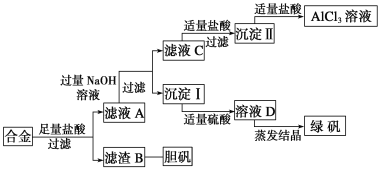
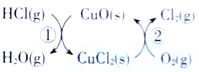

 的合成路线流程图_____________(无机试剂任用)。
的合成路线流程图_____________(无机试剂任用)。