-
下列由实验现象得出的结论正确的是
操作及现象
结论
A
向AgCl悬浊液中加入NaI溶液时出现黄色沉淀。
Ksp(AgCl)< Ksp(AgI)
B
向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色。
溶液中一定含有Fe2+
C
向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色。
Br—还原性强于Cl—
D
加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结。
NH4Cl固体可以升华
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
2019年4月25日,习总书记宣布北京大兴国际机场正式投运!该机场在建设过程中使用了当今世界机场多项尖端科技,被英国《卫报》评为“新世界七大奇迹”之首。化工行业在这座宏伟的超级工程中发挥了巨大作用,下列有关说法错误的是
A.青铜剑科技制造的第三代半导体芯片,其主要成分是SiO2
B.支撑航站楼的C形柱柱顶的多面体玻璃,属于硅酸盐材料
C.机场中的虚拟人像机器人“小兴”表面的塑料属于高分子聚合物
D.耦合式地源热泵系统,光伏发电系统及新能源汽车的使用,可以减轻温室效应及环境污染
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,11.2 L的甲醇所含的氢原子数大于2NA
B.常温下,1 mol •L-1的Na2CO3溶液中CO32-的个数必定小于NA
C.1 mol Cu与含2 mol H2SO4的浓硫酸充分反应,生成的SO2的分子个数为NA
D.1 mol苯分子中含有3NA个碳碳双键
难度: 中等查看答案及解析
-
乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )
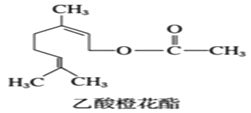
①分子式为C12H19O2;②不能发生银镜反应;③mol该有机物最多能与3mol氢气发生加成反应;④它的同分异构体中不可能有酚类; ⑤1mol该有机物与NaOH溶液反应最多消耗1mol NaOH;⑥属于芳香族化合物。
A.②④⑤ B.①④⑤ C.②③⑥ D.②③④
难度: 中等查看答案及解析
-
W、X、Y、Z为短周期主族元素,原子序数依次增加,W的一种核素在考古时常用来鉴定一些文物的年代。化合物XZ是重要的调味品,Y原子的最外层电子数等于其电子层数,Z-的电子层结构与氩相同。下列说法错误的是
A.元素W与氢形成原子比为1:1的化合物有多种
B.元素X的单质能与水、无水乙醇反应
C.离子Y3+与Z-的最外层电子数和电子层数都不相同
D.元素W与元素Z可形成含有极性共价键的化合物
难度: 中等查看答案及解析
-
传感器可以检测空气中SO2的含量,传感器工作原理如下图所示。下列叙述正确的是( )

A.b为电源的正极
B.负极反应式 Ag - e- + Cl- = AgCl
C.当电路中电子转移为5×10-5mol时进入传感器的SO2为 1.12 mL
D.阴极的电极反应式是2HSO3-+2H++2e-= S2O42-+2H2O
难度: 中等查看答案及解析
-
常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
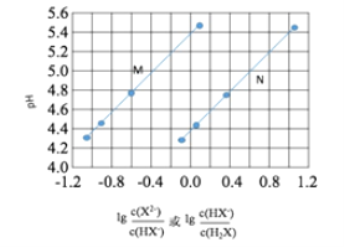
A. Ka2(H2X)的数量级为10–6
B. 曲线N表示pH与
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
难度: 困难查看答案及解析


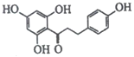 )是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
)是国外新近研究开发出来的一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下: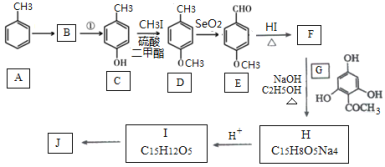
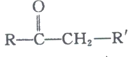 +R’’CHO
+R’’CHO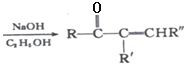 +H2O
+H2O