-
在一定温度和压强下,1LX气体和1LY气体完全反应后生成1L水蒸气和1L氮气。X、Y两种气体是( )
A.H2、N2O4 B.H2、N2O3 C.H2、N2O D.NH3、NO2
难度: 简单查看答案及解析
-
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为4:1:4时,实际参加反应的FeS与HNO3的物质的量之比为
A.1:6 B.2:15 C.2:3 D.16:25
难度: 中等查看答案及解析
-
下图是一稀酸对Fe-Gr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是( )
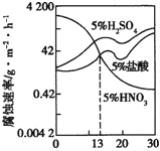
A.稀硝酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是:Fe+6HNO3(稀)=Fe(NO3)3+3NO2↑+3H2O
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强
D.随着Cr含量增加,稀硫酸对Fe-Cr合金的腐蚀性减弱
难度: 简单查看答案及解析
-
研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法不正确的是
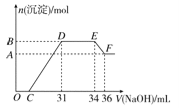
A.OC段离子反应方程式为H++OH-===H2O
B.溶液中n(NH4+)=0.012 mol
C.溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+
D.欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量
难度: 中等查看答案及解析
-
短周期元素X和元素Y,元素X原子的最外层电子数为a,次外层电子数为b;元素Y原子的M层电子数为(a-b),L层电子数为(a+b),则X、Y两元素形成的化合物可能具有的性质是
A.和水反应 B.和硫酸反应 C.和氢氧化钠反应 D.和氯气反应
难度: 简单查看答案及解析
-
在某容积一定的密闭容器中,有下列可逆反应2A(g) + B(g)
xC(g),反应曲线(T表示温度,P表示压强,C% 表示C的体积分数)如图所示,试判断对图的说法中正确的是
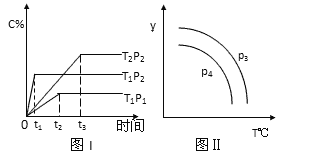
A.x=2 B.该反应是吸热反应
C.P3>P4,y轴表示B的转化率 D.P3<P4,y轴表示混合气体的密度
难度: 中等查看答案及解析