-
运用元素周期律分析下面的推断,其中不正确的是:
A. HBrO4的酸性比HIO4的酸性强
B. 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸
C. 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂
D. 锂(Li)与水反应比钠与水反应剧烈
难度: 中等查看答案及解析
-
用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是 ( )
①幕布的着火点升高 ②幕布的质量增加
③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气
A.①② B.③④ C.①③ D.②④
难度: 简单查看答案及解析
-
氮的固定是指( )
A.植物从土壤中吸收氮肥
B.大豆的根瘤菌将含氮的化合物转变为植物蛋白质
C.将空气中的氮气转变为氮的化合物
D.硝酸和氨气反应生成氮肥
难度: 简单查看答案及解析
-
在1L 1mol/L的氨水中,含有
A.1mol NH3分子
B.只NH3和NH4+两种微粒
C.1mol NH3·H2O
D.NH3、 H2O、NH3·H2O三种分子和NH4+、H+和OH-三种离子
难度: 简单查看答案及解析
-
等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是
A.FeO B.Fe2O3 C.FeSO4 D.Fe3O4
难度: 中等查看答案及解析
-
下列方法适合实验室制取氨气的是
A.N2和H2催化加热制取氨气
B.加热NH4HCO3制取氨气
C.将浓氨水向生石灰固体上滴加
D.将NH4Cl稀溶液和NaOH稀溶液混合
难度: 简单查看答案及解析
-
铜跟1mol/L的硝酸溶液反应,若C(NO3-)下降了0.2mol/L,则C(H+)下降
A.0.2mol/L B.0.8mol/L C.0.6mol/L D.0.4mol/L
难度: 困难查看答案及解析
-
“玉兔”号月球车用
Pu作为热源材料。下列关于
Pu的说法正确的是
A.
Pu与
U互为同位素
B.
Pu与
Pu具有相同的最外层电子数
C.
Pu与
Pu具有相同的中子数
D.
Pu与
U具有完全相同的化学性质
难度: 简单查看答案及解析
-
下列微粒的结构示意图错误的是
A.14C:
B.16O:
C.Li+:
D.H-:
难度: 简单查看答案及解析
-
无机化学命名委员会(国际组织)在1989年作出决定,把长式元素周期表原先的主、副族 及族号取消,由左到右改为18列,如碱金属族为第1列,稀有气体元素为第18列。按此规定 ,下列说法中错误的是
A.第16列是氧族元素
B.第1列金属元素和第17列元素的单质熔、沸点变化趋势相反
C.只有第2列元素原子最外层有2个电子
D.在18列元素中,第3列元素种类最多
难度: 中等查看答案及解析
-
下列离子中,核外电子排布与氩原子相同的是
A.Br- B.F- C.K+ D.Na+
难度: 简单查看答案及解析
-
已知aXm+和bYn+两种离子的电子层结构相同,则a等于
A.b+m+n B.b+m-n C.b-m+n D.b-m-n
难度: 简单查看答案及解析
-
元素X的原子核外M电子层有3个电子,元素Y2-离子核外共有18个电子,则这两种元素可形成的化合物为
A.XY2 B.X2Y C.X2Y3 D.X3Y2
难度: 简单查看答案及解析
-
根据下列原子某层的电子数,能确定该元素的原子序数的是
A.K层上有2个电子 B.L层上有3个电子
C.次外层有8个电子 D.最外层有5个电子
难度: 简单查看答案及解析
-
下列叙述中错误的是 ( )
A.原子半径:Cl>S>O B.还原性:Na>Mg>Al
C.稳定性:HF>HCl>HBr D.酸性:HClO4>H2SO4>H3PO4
难度: 中等查看答案及解析
-
对下列事实解释错误的是( )
A.向蔗糖中加入浓H2SO4后出现发黑现象,说明浓H2SO4具有脱水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D.反应CuSO4+H2S=CuS↓+H2SO4能进行,说明硫化铜既不溶于水,也不溶于稀硫酸
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是

A.元素X与元素Y的最高正化合价之和的数值等于8
B.原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C.离子Y2-和Z 3+的核外电子数和电子层数都相同
D.元素W的最高价氧化物对应的水化物的酸性比Q的强
难度: 中等查看答案及解析
-
同周期的A、B、C三元素,其最高价氧化物对应水化物的酸性强弱顺序是:HAO4>H2BO4>H3CO4,则下列判断错误的是
A.原子半径A>B>C B.气态氢化物稳定性HA>H2B>CH3
C.非金属性A>B>C D.阴离子还原性C3—>B2—>A—
难度: 中等查看答案及解析

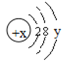 试回答:
试回答: