-
下列叙述正确的是( )
A.100 ℃纯水的pH=6,所以水在100 ℃时呈酸性
B.pH=3的盐酸溶液,稀释至10倍后pH>4
C.0.2 mol·L-1的醋酸,与等体积水混合后pH=1
D.常温时,pH=3的盐酸与pH=11的氢氧化钠等体积混合后pH=7
难度: 简单查看答案及解析
-
下列叙述正确的是 ( )
A.所有卤代烃都难溶于水,且都是密度比水大的液体
B.所有卤代烃都是通过取代反应制得
C.卤代烃不属于烃类
D.卤代烃都可发生消去反应
难度: 简单查看答案及解析
-
下列实验或操作不能达到目的的是( )
A.制取溴苯:将铁屑、溴水、苯混合加热
B.用NaOH溶液除去溴苯中的溴
C.鉴别乙烯和苯:向乙烯和苯中分别滴入酸性KMnO4溶液,振荡,观察是否褪色
D.除去甲烷中含有的乙烯:将混合气体通入溴水中
难度: 中等查看答案及解析
-
下面各物质水解的最终产物中,含有葡萄糖的是( )
A.蛋白质 B.氨基酸 C.油脂 D.麦芽糖
难度: 中等查看答案及解析
-
下列烷烃的系统命名中,不正确的是
A.2,3﹣二甲基戊烷 B.3﹣甲基﹣2﹣乙基己烷
C.3,3﹣二甲基戊烷 D.2﹣甲基丁烷
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.葡萄糖与果糖、淀粉与纤维素均互为同分异构体
B.油脂在酸的催化作用下可发生水解,工业上利用该反应生产肥皂
C.甲烷、苯、乙酸和乙酸乙酯都可发生取代反应
D.向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯
难度: 简单查看答案及解析
-
近年来,多地公共汽车大部分采用天然气作为汽车的燃料,其主要目的是
A.防止石油短缺 B.降低成本
C.减少对大气的污染 D.加大发动机的动力
难度: 简单查看答案及解析
-
25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A.2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol
B.2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C.2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D.H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
难度: 简单查看答案及解析
-
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)
2HBr(g)
H<0;平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
A.a>b B.a=b C.a<b D.无法确定
难度: 中等查看答案及解析
-
已知某弱酸的酸式盐有NaH2XO4和Na2HXO4两种,其中NaH2XO4的溶液呈酸性,Na2HXO4溶液呈碱性。30℃时,NaH2XO4溶液和Na2HXO4溶液,二种溶液的浓度均为0.1mol·L-1,其中均存在的关系是( )
A.c(H+)·c(OH-)=1×10-14
B.c(H+)+2c(H3XO4)+c(H2XO4-)=c(XO43-)+c(OH-)
C.c(Na+)+c(H+)=c(H2XO4-)+c(OH-)+2c(HXO42-)+3c(XO43-)
D.c(H+)+c(H3XO4)=c(HXO42-)+2c(XO43-)+c(OH-)
难度: 中等查看答案及解析
-
如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是 ( )
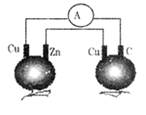
A. 石墨是阴极
B. 两个铜片上都发生氧化反应
C. 锌片是负极
D. 两个番茄都形成原电池
难度: 中等查看答案及解析
-
已知化学反应2C(s)+O2(g)
2CO(g);2CO(g)+O2(g)
2CO2(g)都是放热反应。据此推断在相同条件下,下列说法不正确的是( )
A.56 g CO和32 g O2所具有的总能量之和大于88 g CO2所具有的总能量
B.12 g C所具有的能量一定高于28 g CO所具有的能量
C.12 g C和32 g O2所具有的总能量大于44 g CO2所具有的总能量
D.将两份质量相等的碳完全燃烧,生成CO2的反应比生成CO的反应放出的热量多
难度: 中等查看答案及解析
-
某兴趣小组设计如下微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是
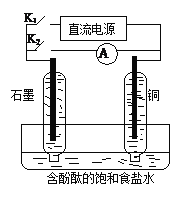
A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl—
Cl2↑+H2↑
B.断开K2,闭合K1时,石墨电极附近溶液变红
C.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e—=2Cl—
D.断开K1,闭合K2时,石墨电极作正极
难度: 中等查看答案及解析
-
在一固定体积的密闭容器中,可逆反应,nA(g)+mB(g)
pC(g)已经达到平衡状态。已知n+m>p,ΔH<0。下列分析结论中正确的是( )
①升温,
的值变小;②降温,平衡体系内混合气体的平均相对分子质量变小;③增加B的物质的量,A的转化率增大;④使用催化剂,气体总的物质的量不变;⑤加压使密闭容器的容积变小,A或B的浓度则变大;⑥若A的反应速率为v(A),则v(B)=
v(A)
A.①② B.②③④ C.③④⑤ D.③④⑥
难度: 中等查看答案及解析
-
已知2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1,则下列关于方程式2H2O(l)=2H2(g)+O2(g)的ΔH的说法中正确的是( )
A. 方程式中的化学计量数表示分子数
B. 该反应ΔH大于零
C. 该反应ΔH=-571.6kJ·mol-1
D. 该反应可表示36g水分解时的热效应
难度: 简单查看答案及解析
-
某温度下,可逆反应mA(g)+nB(g)
pC(g)的平衡常数为K,下列对K的说法正确的是
A.K值越大,表明该反应越有利于C的生成,反应物的转化率越大
B.若缩小反应器的容积,能使平衡正向移动,则K增大
C.温度越高,K一定越大
D.如果m+n=p,则K=1
难度: 简单查看答案及解析
-
为配制澄清的氯化铝溶液,防止氯化铝水解,应在溶液中加入少量:
A.稀盐酸 B.氯化钠 C.氢氧化钠 D.硫酸铝
难度: 简单查看答案及解析
-
在气体参加的反应中,能使反应物中活化分子数和活化分子百分数都增大的方法是
①增大反应物浓度 ②增大压强 ③升高温度 ④加入催化剂 ⑤移去生成物
A.①②③ B.②③④ C.①③④ D.③④
难度: 简单查看答案及解析
-
与等物质的量的Br2发生加成反应,生成的产物是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
在一定的条件下,既可以发生氧化反应又可以发生还原反应,还可以和酸发生酯化反应的是( )
A.乙醇 B.乙醛 C.乙酸 D.葡萄糖
难度: 简单查看答案及解析
-
有下列10种物质:①苯酚,②乙酸,③牛油,④丙氨酸,⑤乙酸乙酯,⑥溴水,⑦甲醛,⑧苛性钠溶液,⑨氯化铁溶液,⑩金属钠。前5种物质中的1种跟后5种物质均能反应;后5种物质中的1种跟前5种物质均能反应,则这两种物质分别是( )
A.①⑥ B.③⑩ C.①⑧ D.②⑨
难度: 中等查看答案及解析
-
有机物X和Y可作为“分子伞”给药载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)。
X(C24H40O5):
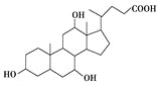
Y:H2NCH2CH2CH2NHCH2CH2CH2CH2NH2
下列叙述错误的是( )
A.1 mol X在浓硫酸作用下发生消去反应,最多生成3 mol H2O
B.1 mol Y发生类似酯化的反应,最多消耗2 mol X
C.X与足量HBr反应,所得有机物的分子式为C24H37O2Br3
D.Y与癸烷的分子链均呈锯齿形,但Y的极性较强
难度: 中等查看答案及解析
-
下列分子中的官能团相同的是( )
①
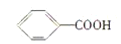 ②
②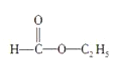 ③
③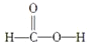 ④C2H5OH
④C2H5OHA.①和② B.③和④ C.①和③ D.②和④
难度: 简单查看答案及解析
-
某物质可能含有:a.甲酸、b.乙酸、c.甲醇、d.甲酸甲酯四种物质中的一种或几种,在鉴别时有下列现象:①可发生银镜反应;②加入新制Cu(OH)2悬浊液,沉淀不溶解;③与含酚酞的NaOH溶液共热,发现溶液中红色逐渐变浅至无色。下列叙述中,正确的是( )
A. a、b、c、d都有
B. 一定有d,可能有c,一定无a、b
C. 有c和d
D. 一定无a,一定有b,可能有c、d
难度: 中等查看答案及解析
-
炒菜时,又加料酒又加醋,可使菜变得香美可口,原因是( )
A.有盐类物质生成 B.有酸类物质生成
C.有油脂类物质生成 D.有酯类物质生成
难度: 简单查看答案及解析
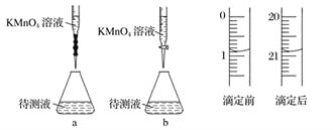
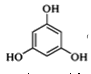 +2CH3OH
+2CH3OH +2H2O
+2H2O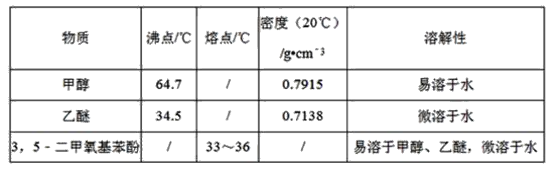

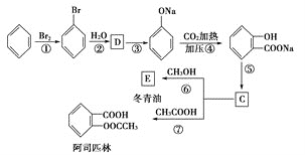
 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。