-
化学与生产、生活及社会发展密切相关。下列说法正确的是
A.聚合硫酸铁[Fe2(OH)x(SO4)y]n,是新型絮凝剂,可用来杀灭水中病菌
B.韩愈的诗句“榆荚只能随柳絮,等闲撩乱走空园”中的柳絮富含糖类
C.宋应星的《天工开物》记载“凡火药,硫为纯阳”中硫为浓硫酸
D.我国发射的“北斗组网卫星”所使用的光导纤维是一种有机高分子材料
难度: 简单查看答案及解析
-
乙烯的产量是衡量一个国家石油化工发展水平的重要标志之一,以乙烯为原料合成的部分产品如图所示。下列有关说法正确的是
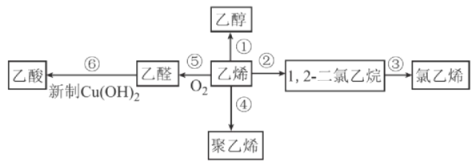
A.氧化反应有①⑤⑥,加成反应有②③
B.氯乙烯、聚乙烯都能使酸性KMnO4溶液褪色
C.反应⑥的现象为产生砖红色沉淀
D.可用乙醇萃取Br2的CCl4溶液中的Br2
难度: 简单查看答案及解析
-
高铁酸钾(K2FeO4)是一种新型非氯高效消毒剂,微溶于KOH溶液,热稳定性差。实验室制备高铁酸钾的原理为3Cl2+2Fe(OH)3+10KOH==2K2FeO4+6KCl++8H2O。下列实验设计不能达到实验目的的是
A.用图
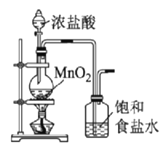 所示装置制备并净化氯气
所示装置制备并净化氯气B.用图
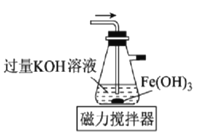 所示装置制备高铁酸钾
所示装置制备高铁酸钾C.用图
 所示装置分离出高铁酸钾粗品
所示装置分离出高铁酸钾粗品D.用图
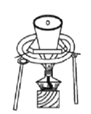 所示装置干燥高铁酸钾
所示装置干燥高铁酸钾难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.14.0gFe发生吸氧腐蚀生成Fe2O3·xH2O,电极反应转移的电子数为0.5NA
B.标准状况下,11.2LH2S溶于水,溶液中含硫粒子的数目大于0.5NA
C.常温下,0.5LpH=14的Ba(OH)2溶液中Ba2+的数目为0.5NA
D.分子式为C2H6O的某种有机物4.6g,含有C-H键的数目一定为0.5NA
难度: 简单查看答案及解析
-
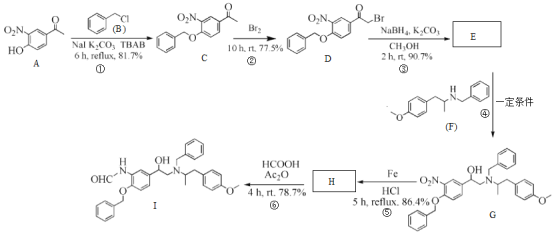
司替戊醇(d)用于治疗两岁及以上 Dravet综合征相关癫痫发作患者,其合成路线如图所示。下列有关判断正确的是
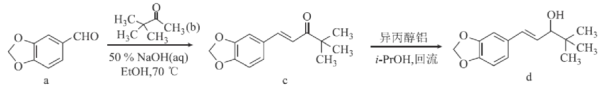
A.b的一氯代物有4种
B.c的分子式为C14H14O3
C.1mold能与4molH2发生加成反应
D.d中所有碳原子可能处于同一平面
难度: 简单查看答案及解析
-
主族元素Q、X、Y、Z、W的原子序数依次增大,且均不大于20,X与Y相邻,Y、W的最外层电子数之和等于Z的族序数,Z的最高正价和最低负价代数和为4,化合物Y2Q4可作为火箭推进剂,普遍用在卫星和导弹的姿态控制上。下列说法错误的是
A.X和Z的单质均存在多种同素异形体
B.Q、Y和Z三种元素只能形成共价化合物
C.Q和W形成的化合物的水溶液呈碱性
D.WZXY溶液常用于Fe3+的检验
难度: 简单查看答案及解析
-
亚磷酸(H3PO3)是二元弱酸,主要用于农药中间体以及有机磷水处理药剂的原料。常温下,向1L0.500mol·L-1H3PO3溶液中滴加等浓度的NaOH溶液,混合溶液中含磷粒子的物质的量分数(δ)与溶液pH的关系如图所示,下列说法正确的是
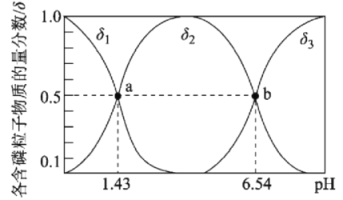
A.a、b两点时,水电离出的c水(OH-)之比为1.43:6.54
B.b点对应溶液中存在:c(Na+)=3c(HPO32-)
C.反应H3PO3+HPO32-
2H2PO3-的平衡常数为105.11
D.当V(NaOH)=1 L 时,c(Na+)>c(H2PO3-)>c(OH-)>c(H+)
难度: 中等查看答案及解析


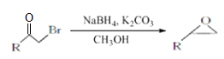 ;
;