-
研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式。以下用于研究有机物的方法错误的是 ( )
A.蒸馏常用于分离提纯液态有机混合物
B.燃烧法是研究确定有机物成分的有效方法
C.对有机物分子红外光谱图的研究有助于确定有机物分子中的基团
D.核磁共振氢谱通常用于分析有机物的相对分子质量
难度: 中等查看答案及解析
-
下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是



A.甲醇低温所制氢气用于新能源汽车
B.氘、氚用作“人造太阳”核聚变燃料
C.偏二甲肼用作发射“天宫二号”的火箭燃料
D.开采可燃冰,将其作为能源使用
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列化学用语对事实的表述正确的是
A.表示甲醇燃烧热的热化学方程式为2CH3OH(l)+3O2(g) =2CO2(g) +4H2O(l) ΔH= -1453kJ/mol
B.少量三氧化硫与氨水反应:SO3+NH3·H2O = NH4++HSO4—
C.在稀溶液中,醋酸与氨水反应的热化学方程式为H+(aq)+ OH—(aq) = H2O(l)△H=-57.3kJ/mol
D.电解饱和食盐水的阳极反应为2Cl— —2e−= Cl2↑
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法不正确的是
A.25℃时,pH=13的1.0LBa(OH) 2溶液中含有的OH-的数目为0.1NA
B.2 gH218O中含有的质子数为NA
C.8 g CuO与足量H2充分反应生成Cu,该反应转移的电子数为0.2NA
D.标准状况下,11.2 L Cl2溶于水,溶液中Cl—、ClO—和HClO的微粒数之和为NA
难度: 中等查看答案及解析
-
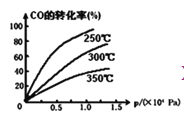
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
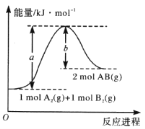
A. 每生成2 mol AB吸收bkJ热量
B. 该反应热△H= + (a-b)kJ • mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出akJ能量
难度: 简单查看答案及解析
-
设N2+3H2
2NH3ΔH<0的反应速率为v1,C+H2O(g)
CO+H2ΔH>0的反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为( )
A.均增大
B.均减小
C.v1增大,v2减小
D.v1减小,v2增大
难度: 简单查看答案及解析
-
工业上利用可逆反应N2(g)+3H2(g)
2NH3(g)合成氨,下列叙述正确的是
A. 合成氨的适宜条件是高温、高压、催化剂,其中催化剂不改变该反应的逆反应速率
B. 恒容通入氩气,使反应体系的压强增大,反应速率一定增大
C. 该反应是放热反应,降低温度将缩短反应达到平衡的时间
D. 在t1、t2时刻,NH3 (g)的浓度分别是c1、c2,则时间间隔t1~t2内,NH3 (g)生成的平均速率为v=(c2-c1)/(t2-t1)
难度: 中等查看答案及解析
-
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
难度: 中等查看答案及解析
-
向1L 0.3 mol/L的NaOH溶液中缓慢通入8.8 g CO2气体,使其完全反应,对反应后的溶液,下列判断正确的是
A.溶质为Na2CO3
B.溶质为Na2CO3和NaHCO3的混合物,常温下,该混合溶液是中性溶液
C.c(Na+)=2[c(HCO3-)+c(CO32-)+c(H2CO3)]
D.c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
难度: 中等查看答案及解析
-
同温等体积等pH的醋酸和盐酸分别加水稀释后,溶液的pH仍相同,则所得溶液的体积
A.醋酸大 B.盐酸大 C.仍相同 D.无法判断
难度: 中等查看答案及解析
-
用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测量结果偏高的是
①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡;②在配制烧碱溶液时,将称量后的NaOH固体溶于水,立即移入容量瓶,将洗涤烧杯的液体注入容量瓶后,加蒸馏水至刻度线;③中和滴定时,锥形瓶内有少量水;④酸式滴定管用蒸馏水洗后,未用标准液润洗;⑤读取滴定管终点读数时,仰视刻度线。
A.①②③ B.③④⑤ C.②④⑤ D.①②③④⑤
难度: 中等查看答案及解析
-
为了得到比较纯净的物质,使用的方法恰当的是
A.向Na2CO3饱和溶液中,通入过量的CO2后,在加热的条件下,蒸发得NaHCO3晶体
B.向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3
C.向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体
D.加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体
难度: 中等查看答案及解析
-
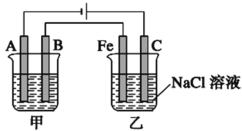
最近,科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是
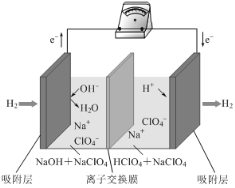
A. 右边吸附层中发生了还原反应
B. 负极的电极反应是H2-2e-+2OH-=2H2O
C. 电池的总反应是2H2+O2=2H2O
D. 电解质溶液中Na+向右移动,
向左移动
难度: 中等查看答案及解析
-
AlPO4的沉淀溶解平衡曲线如图所示(T2>T1).下列说法正确的是( )
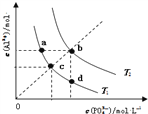
A.图象中四个点的Ksp:a=b>c>d
B.AlPO4在b点对应的溶解度大于c点
C.AlPO4(s)⇌Al3+(aq)+PO43-(aq)△H<0
D.升高温度可使d点移动到b点
难度: 中等查看答案及解析
-
有机物M的结构简式如图所示,与氢气发生加成反应得到物质甲,下列有关说法不正确的是

A.有机物M含有2种官能团
B.有机物M的分子式为C4H6O2
C.有机物M能发生取代反应、加聚反应
D.甲只含有一种官能团的链状同分异构体(不含甲本身)有6种
难度: 中等查看答案及解析
-
已知有机物X、Y、Z的名称和结构简式如下表,下列说法不正确的是
X
Y
Z
名称
3-甲氧基-4-羟基扁桃酸
没食子酸乙酯
丁香酸
结构简式
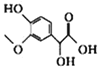
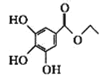
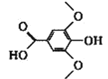
A.X、Y、Z都能与NaOH溶液反应
B.X、Y互为同分异构体,X、Z互为同系物
C.依据X的名称,可推测出Z的名称为3,5-二甲氧基-4-羟基苯甲酸
D.推测出没食子酸的分子式为C7H6O5
难度: 中等查看答案及解析
-
下列表述正确的是
A.氧是宇宙中最丰富的元素
B.门捷列夫按照质子数的多少,将元素排成序,终于发现了元素周期律
C.壁虎能在天花板上爬行自如,源自于它的细毛与墙体之间的强有力的化学键
D.化学模型有助于解释一些化学现象
难度: 中等查看答案及解析
-
下列有关原子轨道的叙述中正确的
A.氢原子的2s轨道能量较3p轨道高
B.能层n=4的原子轨道最多可容纳16个电子
C.p能级的原子轨道呈哑铃形,随着能层序数的增加,p能级原子轨道也在增多
D.锂原子的2s与5s 轨道皆为球形分布
难度: 简单查看答案及解析
-
现有三种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
A.第一电离能:③>①>② B.原子半径:②>①>③
C.最高正化合价:③>②>① D.电负性:③>②>①
难度: 中等查看答案及解析