-
在给定条件下,下列选项所示的物质间转化均能实现的是
A. Fe
FeCl2
Fe(OH)2 B. S
SO3
H2SO4
C. CaCO3
CaO
CaSiO3 D. NH3
NO
HNO3
难度: 中等查看答案及解析
-
某固体物质只含有钠和氧两种元素,将它放在足量的水中产生两种气体,这两种气体又可以在一定条件下反应生成水。则原固体物质的组成是 ( )
A.Na2O2与Na2O B.Na和NaOH C.Na2O2和Na D.Na和Na2O
难度: 中等查看答案及解析
-
下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )


①
②
③
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
难度: 困难查看答案及解析
-
三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
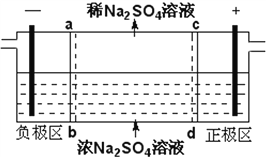
A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
难度: 中等查看答案及解析
-
分析下列反应,在任何温度下均能自发进行的是
A. 2N2(g)+O2(g)=2N2O(g)ΔH=+163 kJ·mol-1
B. Ag(s)+
Cl2(g)=AgCl(s)ΔH=-127 kJ·mol-1
C. HgO(s)=Hg(l)+
O2(g)ΔH=+91 kJ·mol-1
D. H2O2(l)=
O2(g)+H2O(l)ΔH=-98 kJ·mol-1
难度: 简单查看答案及解析
-
298 K时,在20.0 mL 0.10mol·L-1氨水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1 氨水的电离度为1.32%,下列有关叙述正确的是
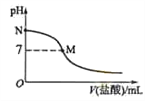
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
难度: 中等查看答案及解析
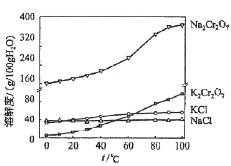
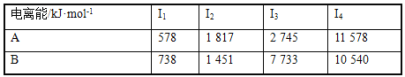
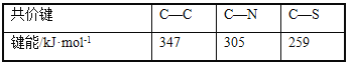
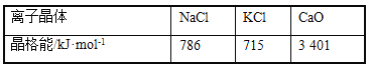

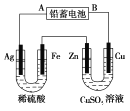
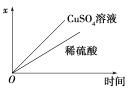

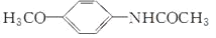 )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(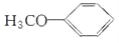 )制备4甲氧基乙酰苯胺的合成路线__(其他试剂任选)。
)制备4甲氧基乙酰苯胺的合成路线__(其他试剂任选)。