-
有氯化钠、氯化铁、氯化亚铁、氯化镁、氯化铝五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( )
A. 盐酸 B. 烧碱溶液
C. 氨水 D. 硫氰化钾溶液
难度: 中等查看答案及解析
-
下列有关容量瓶的四种说法,正确的一组是
①标有使用温度、容积和一条刻度线;
②不宜贮存溶液;
③不能用来加热,不能作反应器;
④使用之前要检查是否漏水;
⑤容量瓶用蒸馏水洗净后,应干燥后再配制溶液。
A. 仅①②③④ B. 仅②③ C. 仅①②④⑤ D. 仅②③④
难度: 简单查看答案及解析
-
下列各组气体在通常情况下既能用浓硫酸又能用碱石灰干燥的是( )
A. SO2、O2、N2 B. HCl、Cl2、CO2
C. CH4、H2、CO D. SO2、O2、Cl2
难度: 简单查看答案及解析
-
下列变化不可能通过一步实验直接完成的是( )
A.Al(OH)3 → Al2O3 B.Al2O3 → Al(OH)3
C.Al → AlO2- D.Al3+ → Al(OH)3
难度: 简单查看答案及解析
-
水热法制备Fe3O4纳米颗粒的反应如下(反应条件忽略):3Fe2++ 2S2O32-+O2+xOH-= Fe3O4+ S4O62-+2H2O。下列说法不正确的是
A.每生成1mol Fe3O4,转移4mol电子
B.该反应中Fe2+和S2O32-都是还原剂
C.3mol Fe2+被氧化时有1molO2被还原
D.离子方程式中x=4
难度: 中等查看答案及解析
-
对于铵盐的描述都正确的是( )
①都溶于水 ②都是白色晶体 ③都有刺激性气味 ④加热后都有氨气放出 ⑤与碱混合后加热都有氨气放出 ⑥都能使湿润的红色石蕊试纸变蓝
A.全部
B.①②⑤⑥
C.①②⑤
D.③④⑤
难度: 中等查看答案及解析
-
地壳中含量位于第一、二位的元素之间形成的化合物不具有的性质是( )
A.常温下能与苛性钠反应 B.常温下能与水反应
C.常温下能与氢氟酸反应 D.高温时能与氧化钙反应
难度: 简单查看答案及解析
-
把铁片放入下列溶液中,铁片溶解且溶液质量减小,没有气体生成,此溶液是( )
A.冷浓硝酸 B.稀硫酸 C.硫酸铁 D.硫酸铜
难度: 简单查看答案及解析
-
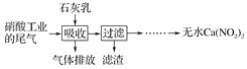
下列说法中不正确的是( )。
A.硫酸工业的尾气必须回收、净化处理,主要为了充分利用原料
B.“酸雨”中主要含有硫的氧化物以及所形成的硫酸及硫酸盐
C.大气中,大量的SO2来源于煤和石油燃烧、金属矿石的冶炼
D.消除大气污染的主要方法之一是减少污染物的排放
难度: 简单查看答案及解析
-
下列反应中,通入的气体只作还原剂的是( )
A. 二氧化硫通入溴水中
B. 氯气通入氢氧化钠溶液中
C. 二氧化硫通入氢氧化钾溶液中
D. 氧气通入亚硫酸溶液中
难度: 简单查看答案及解析
-
镁粉在焰火、闪光粉、鞭炮中是不可缺少的原料,工业制造镁粉是将镁蒸气在某冷却剂中冷却。①空气、②氧气、③氩气、④氢气、⑤氮气、⑥二氧化碳,其中可作为镁蒸气冷却剂的是
( )
A.①② B.③④ C.③⑥ D.③⑤
难度: 简单查看答案及解析
-
下列物质混合后,不会发生离子反应的是( )
A.硫酸钠溶液和氯化钡溶液
B.醋酸钠溶液和稀硫酸
C.碳酸氢钙溶液和硫酸氢钠溶液
D.小苏打溶液和氯化钡溶液
难度: 简单查看答案及解析
-
关于酸、碱、盐的下列说法中错误的是( )
A. 酸在水溶液中电离产生的阳离子全部是氢离子
B. 碱在水溶液中电离产生的阴离子全部是氢氧根离子
C. 盐在水溶液中电离一定有金属阳离子产生
D. 酸和盐在水溶液中电离都可能有含氧酸根离子产生
难度: 中等查看答案及解析
-
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是( )
A.2Na2O2+2H2O=4NaOH+O2↑ B.4Fe(OH)2+O2+2H2O=4Fe(OH)3
C.2Na+2H2O=2NaOH+H2↑ D.Cl2+H2O=HCl+HClO
难度: 简单查看答案及解析
-
把各组中的气体通入溶液中,溶液的导电能力显著增强的是( )
A.CO2(g)通入NaOH溶液 B.CO2(g)通入石灰水
C.NH3(g)通入CH3COOH溶液 D.NH3(g)通入盐酸中
难度: 中等查看答案及解析
-
已知2Fe2++Br2=2Fe3++2Br-。向100mL的FeBr2溶液中通入标准状况下的Cl2 3.36L,充分反应后测得溶液中Cl-与Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为
A.2 mol/L B.1 mol/L C.0.4 mol/L D.0.2 mol/L
难度: 中等查看答案及解析
-
将6.5g锌加入到200mL1mol·L-1稀硫酸中,在标准状况下,可产生氢气的体积是( )
A.4.48L B.3.36L C.2.24L D.1.12L
难度: 简单查看答案及解析
-
以下表示的是碳及其化合物的转化关系,其中涉及的基本反应类型依次是( )
C
CO2
H2CO3
CaCO3
CO2
A.化合、置换、分解、复分解 B.置换、复分解、化合、分解
C.置换、化合、分解、复分解 D.置换、化合、复分解、分解
难度: 简单查看答案及解析
-
在过滤实验中,不需要用到的仪器是( )
A.玻璃棒 B.胶头滴管 C.烧杯 D.漏斗
难度: 简单查看答案及解析
-
在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失。下列判断不正确的是( )
A.氧化性:ClO->I2>SO42-
B.漂白粉溶液可使淀粉碘化钾试纸变蓝
C.向氯水中加入亚硫酸钠溶液,氯水褪色
D.次氯酸钠与亚硫酸钠在酸性条件下可以共存
难度: 中等查看答案及解析
-
下列反应属于氧化还原反应的是( )
A. CaCO3+2HCl=CaCl2+CO2↑+H2O B. CaO+H2O=Ca(OH)2
C. 2H2O2
2H2O+O2↑ D. CaCO3
CaO+CO2↑
难度: 简单查看答案及解析
-
将100 mL 0.1 mol·L-1的氯化钡溶液与50 mL 0.2 mol·L-1的氯化钠溶液混合,若不考虑溶液混合时体积的变化,则混合溶液中氯离子浓度是
A.0.2 mol·L-1 B.0.01 mol·L-1
C.0.1 mol·L-1 D.0.02 mol·L-1
难度: 简单查看答案及解析
-
离子方程式Ba2++SO42-=BaSO4↓可以表示( )
①可溶性钡盐溶液与可溶性硫酸盐溶液之间的反应
②氢氧化钡溶液与可溶性硫酸盐溶液之间的反应
③稀硫酸与可溶性钡盐溶液之间的反应
④氢氧化钡溶液与稀硫酸之间的反应
A.① B.①②④ C.②③ D.①②③
难度: 困难查看答案及解析
-
下列说法正确的是 ( )。
A.所有不锈钢都只含有金属元素
B.我国流通的硬币材质是金属单质
C.广东打捞的明代沉船上存在大量铝制餐具
D.镁合金的硬度和强度均高于纯镁
难度: 简单查看答案及解析
-
在溶液中能大量共存的离子组是( )
A.Ag+ Cl- Na+ B.H+ OH- K+
C.K+
Ca2+ D.Al3+ OH- Cl-
难度: 中等查看答案及解析