-
央视栏目《国家宝藏》不仅彰显民族自信、文化自信,还蕴含着许多化学知识。下列说法不正确的是
A. 战国·“曾候乙编钟”属于青铜制品,青铜是一种铜锡合金
B. 宋·《莲塘乳鸭图》缂丝中使用的丝,主要成分是蛋白质
C. 宋·王希孟《千里江山图》中的绿色颜料铜绿,主要成分是碱式碳酸铜
D. 清·乾隆“瓷母”是指各种釉彩大瓶,其主要成分是二氧化硅
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等
B.1mol过氧化钠分别与足量CO2、SO2反应,转移的电子数均为2NA
C.10g质量分数为46%的乙醇水溶液中含有的氢原子总数为1.2NA
D.1molFe(OH)3与含3molHI的溶液完全反应后,溶液中所含I-的数目为3NA
难度: 中等查看答案及解析
-
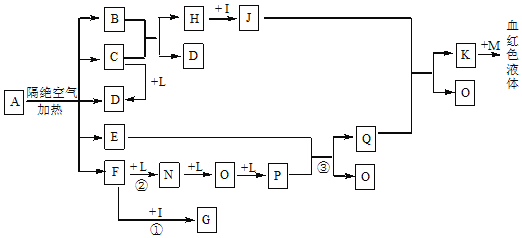
网络趣味图片“一脸辛酸”,是在脸上重复画满了辛酸的键线式结构。下列有关辛酸的叙述正确的是
A. 辛酸的同分异构体(CH3)3CCH (CH3) CH2COOH的名称为 2,2,3-三甲基戊酸
B. 辛酸的羧酸类同分异构体中,含有3个“一CH3”结构,且存在乙基支链的共有7种(不考虑立体异构)
C. 辛酸的同分异构体中能水解生成相对分子质量为74的有机物的共有8种(不考虑立体异构)
D. 正辛酸常温下呈液态,而软脂酸常温下呈固态,故二者不符合同一通式
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色、无味的气体。上述物质间的转化关系如图所示。下列说法错误的是( )
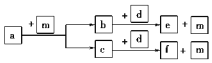
A.简单阴离子的还原性:Y>W
B.简单离子半径:Z<Y
C.简单气态氢化物的热稳定性:Y>X
D.W、Y、Z形成的化合物含有共价键
难度: 困难查看答案及解析
-
下列离子方程式书写及评价合理的是
离子方程式
评价
A
Mg(HCO3)2溶液中加入足量的NaOH溶液
Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O
正确,NaOH过量,酸式盐与碱完全反应生成正盐和水;
B
1mol/L 的 NaA1O2溶液与2.5mol/L 的 HC1 溶液等体积混合
2 A1O2+5H+=A13++Al(OH)3+H2O
正确,A1O2-与H+按物质的量1:1反应转化为Al(OH)3,过量的H+再将一半Al(OH)3转化为Al3+
C
将少量的Fe3O4溶解在过量的稀HNO3中
Fe3O4+8H+=Fe2++2Fe3++4H2O
正确,Fe3O4化学式可改写为FeO·Fe2O3,Fe2+与Fe3+,物质的量之比为1∶2
D
将FeCl2溶液加入到NaClO洛液中 Fe2++2C1O-+2H2O= Fe(OH)2↓+2HC1O
错误,Fe2+与C1O-会发生氧化还原反应:
2Fe2++C1O-+5H2O=2Fe(OH)3↓+Cl-+4H+
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
下列实验现象与对应结论均正确的是( )
选项
A
向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液
溶液变为黄色
氧化性:H2O2>Fe2+
B
向硅酸钠溶液中滴加盐酸
溶液变浑浊
氯的非金属性强于硅,故而盐酸能制得硅酸
C
向溴水中滴加苯,振荡后静置
液体出现分层,上层有颜色,下层按近无色
相同温度下,溴在苯中的溶解度远大于其在水中的溶解度。
D
将过量过氧化钠固体投入紫色石蕊试液中
溶液变成蓝色
过氧化钠与水反应生成氢氧化钠,溶液呈碱性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某科研小组模拟的“人工树叶”电化学装置如图所示,该装置能将H2O和CO2转化为糖类(C6H12O6)和O2,X、Y是特殊催化剂型电极。已知装置的电流效率等于生成产品所需的电子数与电路中通过的总电子数之比。下列说法不正确的是( )
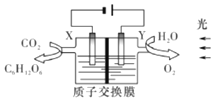
A.该装置中Y电极发生氧化反应
B.X电极的电极反应式为6CO2+24e-+24H+=C6H12O6+6H2O
C.理论上,每生成22.4LCO2必有4molH+由Y极区向X极区迁移
D.当电路中通过3mol电子时生成18gC6H12O6,则该装置的电流效率为80%
难度: 中等查看答案及解析
-
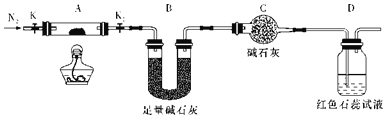
《战争的气体化学和分析》中介绍了一种制取rad(光气,熔点为-118℃,沸点为8.2℃,微溶于水,易溶于甲苯等有机溶剂)的方法,其实验装置如图所示(夹持装置已省略),下列说法正确的是( )
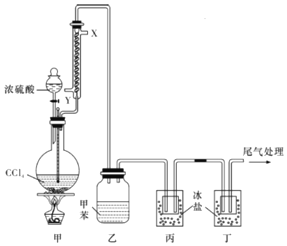
A.该反应属于氧化还原反应
B.自来水从冷凝管的X 口通入
C.可将装置丁的尾气通过导管直接通入NaOH溶液中进行尾气处理
D.装置乙中可收集到光气的甲苯溶液,装置丙、丁中均可收集到液态光气
难度: 中等查看答案及解析
-
向含amol H2S水溶液中通入bmol Cl2,当通入的Cl2少量时,产生浅黄色浑浊,增加通C12的量,浅黄色浑浊逐渐消失,最后成为无色溶液,溶液呈酸性,下列说法不正确的是
A.当b≤a时,发生的离子方程式:H2S+Cl2=2H++S↓+2Cl-
B.当 2a=b 时,发生的离子方程式:3H2S+6Cl2+4H2O=14H++2S↓+SO42-+12Cl-
C.当a≤b≤4a时,反应中转移电子的物质的量n(e-)为2amol≤n(e-)≤8amol
D.当a<b<4a时,溶液中的S、SO42-、Cl-的物质的量比为(4a-b)∶(b-a)∶2b
难度: 困难查看答案及解析
-
下列有关实验的操作正确的是
A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗
B.检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸
C.为观察Mg条在CO2气体中的燃烧,在一个底部铺有少量玻璃棉的集气瓶中收集满 CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部。
D.用干燥且洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH值
难度: 中等查看答案及解析
-
已知:298K时,四种物质的溶度积如表所示。下列说法正确的是( )
化学式
CH3COOAg
AgCl
Ag2CrO4
Ag2S
Ksp
2.3×10-3
1.56×10-10
1.12×10-12
6.3×10-50
A.298K时,将0.001mol⋅L-1的AgNO3溶液逐滴滴入0.001mol⋅L-1的KCl和0.001mol⋅L-1的K2CrO4的混合液中,则先产生Ag2CrO4沉淀
B.298K时,向2.0×10-4mol⋅L-1的K2CrO4溶液中加入等体积的2.0×10-4mol⋅L-1的AgNO3溶液,则有Ag2CrO4沉淀生成(忽略混合时溶液体积的变化)
C.298K时,向CH3COOAg悬浊液中加入盐酸,发生反应的离子方程式为CH3COOAg+H++Cl-⇌CH3COOH+AgCl
D.已知:
=0.65,298K时,四种物质的饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
难度: 中等查看答案及解析
-
工业上由黄铜矿(主要成分为CuFeS2)冶炼铜的主要流程如图所示:
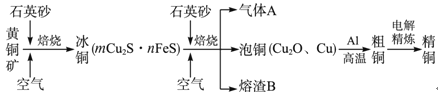
下列说法正确的是( )
A.由黄铜矿到冰铜的反应中,氧化剂是空气,还原剂是CuFeS2
B.气体A中的大气污染物可以用NaOH溶液或氨水吸收
C.将熔渣B用稀硫酸浸泡,取少量所得溶液,滴加KSCN溶液后呈红色,说明熔渣B 中的铁元素显+3价
D.由泡铜到粗铜的反应为吸热反应
难度: 中等查看答案及解析
-
温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应: 2NO2(g)
2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v (NO2 )消耗= k正c2(NO2 ),v逆= v(NO)消耗= 2v (O2 )消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是
容器
编号
物质的起始浓度(mol·L-1)
物质的平衡浓度(mol·L-1)
c(NO2)
c(NO)
c(O2)
c(O2)
Ⅰ
0.6
0
0
0.2
Ⅱ
0.3
0.5
0.2
Ⅲ
0
0.5
0.35
A.设k为该反应的化学平衡常数,则有k=k逆:k正
B.达平衡时,容器Ⅱ与容器Ⅲ中的总压强之比为20∶17
C.容器Ⅱ中起始平衡正向移动,达平衡时,容器Ⅱ中NO2的转化率比容器Ⅰ中的小
D.若改变温度为T2,且T2>T1,则k正:k逆<0.8
难度: 中等查看答案及解析
-
已知HX和HY是两种一元弱酸,常温下用NaOH溶液分别滴定这两种弱酸溶液,若pKa=-lgKa,y=
或lg
,得到y和溶液pH的变化关系如图所示。下列有关叙述错误的是( )
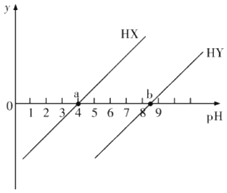
A.常温下,Ka(HX)=10-4,Ka(HY)=10-8.5
B.a点溶液中,c(X-)=c(HX)>c(Na+)>c(H+)>c(OH-)
C.常温下,0.1mol/LNaX溶液pH大于0.1mol/LNaY溶液的pH
D.往HY溶液中滴入NaOH溶液后所得的混合溶液中,
=10pH-pKa(HY)
难度: 困难查看答案及解析
-
下列事实不能用化学平衡移动原理解释的是( )
A.用排饱和食盐水法收集氯气
B.加压条件有利于N2和H2反应生成NH3
C.将盛有NO2的球浸泡在热水中颜色加深
D.加催化剂,使N2和H2在一定的条件下转化为NH3
难度: 中等查看答案及解析
-
铝土矿的主要成分为A12O3、Fe2O3和SiO2,工业上经过下列流程冶炼铝:
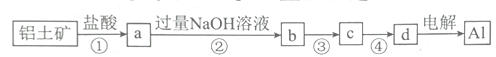
下列说法正确的是
A. ①、②中除加试剂外,还需要进行蒸发结晶
B. a、b中铝元素的化合价不同
C. ③中可通入过量的CO2
D. ④进行的操作为过滤、洗涤、灼烧,且d为A1C13
难度: 中等查看答案及解析