-
下列有关燃料的说法错误的是
A.燃料燃烧产物CO2是温室气体之一
B.化石燃料完全燃烧不会造成大气污染
C.以液化石油气代替燃油可减少大气污染
D.燃料不完全燃烧排放的CO是大气污染物之一
难度: 简单查看答案及解析
-
某校化学兴趣小组在实验室发现一瓶溶液,标签上标有“CaCl20.1mol·L-1”的字样,下面是该小组成员对溶液的叙述,正确的是( )
A.配制1L该溶液,可将0.1molCaCl2溶于1L水中
B.Ca2+和Cl-的物质的量浓度都是0.1mol·L-1
C.从试剂瓶中取该溶液的一半,则所取溶液的物质的量浓度为0.05mol·L-1
D.将该瓶溶液稀释一倍,则所得溶液的c(Cl-)为0.1mol·L-1
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 氧化剂本身发生氧化反应
B. 氧化还原反应一定有氧元素参加
C. 氧化剂在反应中得电子,还原剂失去电子
D. 氧化反应一定先于还原反应发生
难度: 简单查看答案及解析
-
城市环保部门为了使生活垃圾得到合理利用,实施了生活垃圾分类投放的办法。其中塑料袋、废纸、旧橡胶等属于( )
A.无机物
B.有机物
C.盐类
D.非金属
难度: 中等查看答案及解析
-
相同条件,相同分子数的各种气体的体积相同,其主要原因是( )
A.粒子大小相同 B.粒子质量相同
C.粒子间距离相同 D.粒子间作用力相同
难度: 中等查看答案及解析
-
下列关于金属铝的叙述中,说法不正确的是
A.铝的化学性质很活泼,但在空气中不易锈蚀
B.铝是比较活泼的金属,在化学反应中容易失去电子,表现出还原性
C.铝箔在空气中受热可以熔化,且发生剧烈燃烧
D.铝箔在空气中受热可以熔化,但由于氧化膜的存在,熔化的铝并不滴落
难度: 简单查看答案及解析
-
下列关于物质的量的解释中不正确的是( )
A.物质的量是国际单位制的基本单位之一
B.物质的量常用符号n表示
C.摩尔是物质的量的单位
D.物质的量是一个独立的专有名词
难度: 简单查看答案及解析
-
硫单质在反应3S+6KOH===2K2S+K2SO3+3H2O中的变化是
A. 被氧化 B. 被还原 C. 既被氧化又被还原 D. 既未被氧化又未被还原
难度: 简单查看答案及解析
-
下列说法中,正确的是( )
A.SiO2和CO2常温都是气体
B.CO2、SiO2均能和氢氟酸反应
C.CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应
D.CO2、SiO2均可与水反应制得相应酸
难度: 简单查看答案及解析
-
关于酸、碱、盐的下列各种说法中正确的是( )
A. 水溶液中能电离出氢离子的化合物都是酸
B. 水溶液中能电离出氢氧根离子的化合物都是碱
C. 水溶液中不能电离出金属阳离子的氯化铵不是盐
D. 水溶液中能电离出金属阳离子和酸根离子的化合物是盐
难度: 简单查看答案及解析
-
下列关于分散系的说法不正确的是
A.分散系的稳定性:溶液>胶体>浊液
B.分散质粒子的大小:溶液>胶体>浊液
C.分散质粒子的直径为几纳米或几十纳米的分散系是胶体
D.可以用过滤的方法将悬浊液中的分散质从分散剂中分离出来
难度: 简单查看答案及解析
-
下列有关硅和二氧化硅的用途错误的是( )
A.硅单质作耐火材料 B.晶体硅作半导体材料
C.二氧化硅作光导纤维材料 D.高纯硅作计算机芯片材料
难度: 中等查看答案及解析
-
用金属铜制取硝酸铜,从节约原料和防止环境污染方面考虑,最好的方法是( )
A.铜
硝酸铜 B.铜
硝酸铜
C.铜
氯化铜
硝酸铜 D.铜
氧化铜
硝酸铜
难度: 中等查看答案及解析
-
将过量的二氧化碳分别通入:①氯化钙溶液 ②硅酸钠溶液 ③氢氧化钙溶液 ④饱和碳酸钠溶液。最终溶液中有白色沉淀析出的是( )
A.①②③④
B.②④
C.①②③
D.②③
难度: 中等查看答案及解析
-
据报道我国科学家最近研制出一种新型“连续纤维增韧”航空材料,其主要成分是由碳化硅、陶瓷和碳纤维复合而成。下列相关叙述不正确的是( )
A.它耐高温抗氧化
B.它比钢铁轻、硬,但质地较脆
C.它没有固定熔点
D.它是一种新型无机非金属材料
难度: 中等查看答案及解析
-
用足量的CO还原32.0 g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60 g沉淀,则该氧化物是
A.FeO B.Fe2O3 C.CuO D.Cu2O
难度: 中等查看答案及解析
-
以下不属于无机非金属材料的是( )
A.玻璃 B.铝合金 C.水泥 D.陶瓷
难度: 中等查看答案及解析
-
以油类为溶剂的防锈漆称为油基防锈漆,由于环保方面的原因,目前要推广使用水基防锈漆,但水基漆较易溶解O2,在干燥之前易导致金属表面产生锈斑,为此要在水基漆中加入缓蚀剂,以下可作为缓蚀剂添加的是
A.KMnO4 B.NaNO2 C.FeCl3 D.HNO3
难度: 简单查看答案及解析
-
在反应SiO2+3C
SiC+2CO↑中,氧化剂与还原剂的质量比是
A. 36∶60 B. 60∶36 C. 1∶2 D. 1∶3
难度: 简单查看答案及解析
-
如图装置用来检验氯气的部分性质,下列说法不正确的是( )
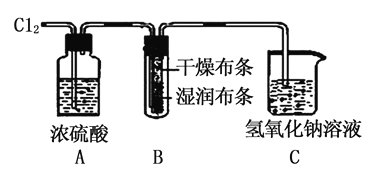
A. 装置A的作用是除去氯气中的水蒸汽
B. 该实验必须在通风橱中进行
C. 装置C中发生反应为Cl2+2NaOH=NaCl+NaClO+H2O
D. 装置B的现象是干燥处布条褪色,湿润处布条不褪色
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.氧化反应一定是化合反应
B.凡是两种或两种以上的物质发生的反应就是化合反应
C.物质只有和氧气发生化合反应才是氧化反应
D.镁条在氧气中燃烧既属于化合反应又属于氧化还原反应
难度: 中等查看答案及解析
-
实验室配制一定物质的量浓度的溶液,一定要用到的一组仪器是( )
A. 托盘天平、药匙、烧杯、容量瓶
B. 量筒(或滴定管、移液管)、容量瓶
C. 容量瓶、烧杯、玻璃棒、胶头滴管
D. 容量瓶、烧杯、玻璃棒、分液漏斗
难度: 简单查看答案及解析
-
下列电离方程式错误的是( )
A. NaHCO3=Na++H++CO32- B. NaHSO4=Na++H++SO42-
C. BaCl2=Ba2++2Cl- D. Na2SO4=2Na++SO42-
难度: 简单查看答案及解析
-
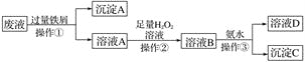
海水开发利用的部分过程如图所示。下列说法错误的是
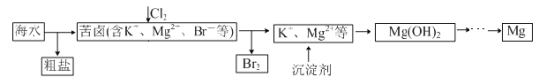
A.粗盐可采用除杂和重结晶等过程提纯
B.向苦卤中通入Cl2是为了提取溴
C.实际生产中常选用Ca(OH)2 作为沉淀剂
D.工业生产中电解熔融氧化镁的方法制取镁
难度: 中等查看答案及解析
-
有关氧化还原反应的下列叙述正确的是( )
A. 氧化剂发生还原反应,还原剂发生氧化反应
B. 氧化剂被氧化,还原剂被还原
C. 一个氧化还原反应中,氧化剂和还原剂一定是两种不同的物质
D. 氧化还原反应中,金属单质只作还原剂,非金属单质只作氧化剂
难度: 中等查看答案及解析
-
电闪雷鸣的雨天,空气中的氮气会发生一系列反应,生成氮的化合物。雷雨时,一般不可能生成的氮的化合物的是( )
①NH3 ②NO ③NO2 ④N2O3 ⑤N2O5 ⑥HNO3
A. ①④⑤ B. ①③⑤ C. ②④⑥ D. ②③⑤⑥
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.40gNaOH溶于水所得1L溶液的浓度为1mol·L-1
B.1mol·L-1的Na2CO3溶液中Na+的浓度为1mol·L-1
C.从1L0.1mol·L-1的NaCl溶液中取出0.1L溶液,则NaCl的浓度变为0.01 mol·L-1
D.1L0.2 mol·L-1的Na2SO4溶液中,Na+的物质的量为0.2 mol
难度: 简单查看答案及解析
-
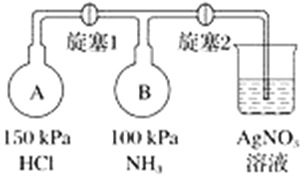
当不慎有大量Cl2扩散到周围空间时,处在环境中的人们可以用浸有一定浓度某种物 质水溶液的毛巾捂住鼻子,以防中毒,该物质最适宜采用的是
A.NaOH B.NaCl C.NaHCO3 D.NH3
H2O
难度: 简单查看答案及解析