-
在稳定人体血液的pH中起作用的离子是
A.Na+ B.HCO3- C.Fe2+ D.Cl-
难度: 简单查看答案及解析
-
下列食品添加剂中,其使用目的与反应速率有关的是( )
A.抗氧化剂 B.调味剂
C.着色剂 D.增稠剂
难度: 中等查看答案及解析
-
中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。已知:铟与铝(13Al)同主族。下列说法错误的是( )
A.In 的金属性大于 Al
B.In 最外层有 2 种能量的电子
C.
In 的中子数为 66
D.
In 原子的相对原子质量为 115
难度: 简单查看答案及解析
-
下列各组物质所含化学键相同的是( )
A.钠(Na)与金刚石(C)
B.氯化钠(NaCl)与氯化氢(HCl)
C.氯气(Cl2)与氦气(He)
D.碳化硅(SiC)与二氧化硅(SiO2)
难度: 简单查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.NaCl(aq)
Cl2(g)
FeCl2(s)
B.S(s)
SO3(g)
H2SO4(aq)
C.Al(s)
AlCl3(aq)
Al(OH)3(s)
D.N2(g)
NH3(g)
Na2CO3(s)
难度: 中等查看答案及解析
-
在一定条件下,甲苯可生成二甲苯混合物和苯。有关物质的沸点、熔点如下表:
对二甲苯
邻二甲苯
间二甲苯
苯
沸点/℃
138
144
139
80
熔点/℃
13
-25
-47
6
下列说法错误的是( )
A.该反应属于取代反应
B.用蒸馏的方法可将苯从反应所得产物中首先分离出来
C.甲苯和氢气完全反应所得产物的分子式是 C7H16
D.对二甲苯的一溴代物有 2 种
难度: 中等查看答案及解析
-
β−月桂烯的结构如图所示,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有( )
A.2种 B.3种 C.4种 D.6种
难度: 中等查看答案及解析
-
维通橡胶是一种耐腐蚀、耐油、耐高温、耐寒性能都特别好的氟橡胶。它的结构简式见图,合成它的单体可能为( )
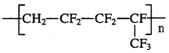
A.
B.CH2=CF2 和 CF2=CFCF3
C.
D.
难度: 中等查看答案及解析
-
下列物质和铁不可能发生反应的是( )
A.Al2O3 B.H2O C.浓硝酸 D.O2
难度: 简单查看答案及解析
-
设 NA 为阿伏加德常数的数值,下列说法正确的是( )
A.18 g H2O 含有 10NA 个质子
B.1 mol 苯含有 3NA 个碳碳双键
C.标准状况下,22.4 L 氨水含有 NA 个 NH3 分子
D.常温下,112 g 铁片投入足量浓 H2SO4 中生成 3NA 个 SO2 分子
难度: 中等查看答案及解析
-
下列各组物质发生反应,生成产物有硫的是( )
A.Na2S2O3 溶液和 HCl 溶液 B.H2S 气体在足量的 O2 中燃烧
C.碳和浓硫酸反应 D.铜和浓硫酸反应
难度: 中等查看答案及解析
-
下列有关酸碱滴定实验操作的叙述错误的是( )
A.准备工作:先用蒸馏水洗涤滴定管,再用待测液和标准液洗涤对应滴定管
B.量取 15.00mL 待测液:在 25 mL 滴定管中装入待测液,调整初始读数为 10.00mL后,将剩余待测液放入锥形瓶
C.判断滴定终点:指示剂颜色突变,且半分钟内不变色
D.读数:读蓝线粗细线交界处所对应的刻度,末读数减去初读数即反应消耗溶液的体积
难度: 中等查看答案及解析
-
下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)( )
A.
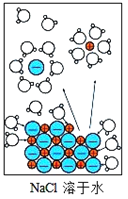 NaCl→Na++Cl-
NaCl→Na++Cl-B.
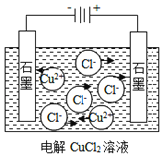 CuCl→Cu2++2Cl-
CuCl→Cu2++2Cl-C.
 CH3COOH⇌CH3COO-+H+
CH3COOH⇌CH3COO-+H+D.
 H2 (g)+Cl2 (g)→2HCl(g)+183kJ
H2 (g)+Cl2 (g)→2HCl(g)+183kJ难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是( )
A.NH4HCO3 受热易分解,可用作化肥
B.NaHCO3 溶液显碱性,可用于制胃酸中和剂
C.SO2 具有氧化性,可用于纸浆漂白
D.Al2O3 具有两性,可用于电解冶炼铝
难度: 简单查看答案及解析
-
短周期主族元素 X、Y、Z、W 原子序数依次增大,X 原子的最外层有 6 个电子,Y 是迄今发现的非金属性最强的元素,在周期表中 Z 位于 IA 族,W 与 X 属于同一主族。下列说法正确的是( )
A.熔沸点:Z2X<Z2W B.元素最高价:Y<Z
C.气态氢化物的热稳定性:Y<W D.原子半径:X<Y<Z<W
难度: 中等查看答案及解析
-
下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I−的Cl2
D. 用装置丁吸收氧化浸泡液中I−后的Cl2尾气
难度: 中等查看答案及解析
-
将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( )

A.在此实验过程中铁元素被还原
B.铁腐蚀过程中化学能全部转化为电能
C.活性炭的存在会加速铁的腐蚀
D.以水代替NaCl溶液,铁不能发生吸氧腐蚀
难度: 中等查看答案及解析
-
下列反应颜色变化和解释原因相一致的是( )
A.氯水显黄绿色:氯气和水反应生成的次氯酸为黄绿色液体
B.氢氧化钠溶液滴加酚酞显红色:氢氧化钠水解使溶液显碱性
C.乙烯使溴水褪色:乙烯和溴水发生氧化反应
D.碘在苯中的颜色比水中深:碘在有机物中的溶解度比水中大
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是( )
A.向盐酸中加入氨水至中性,溶液中
>1
B.醋酸溶液和氢氧化钠溶液恰好反应,溶液中
>1
C.向 0.1mol⋅L-1 CH3COOH 溶液中加入少量水,溶液中
减小
D.将 CH3COONa 溶液从 20℃升温至 30℃,溶液中
增大
难度: 中等查看答案及解析
-
在密闭容器中,可逆反应aA(g)⇌bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡建立时, B的浓度是原来的 60%,则新平衡较原平衡而言,下列叙述错误的是( )
A.平衡向正反应方向移动
B.物质 A 的转化率增大
C.物质 B 的质量分数减小
D.化学计量数 a 和 b 的大小关系为a<b
难度: 简单查看答案及解析



 是一种新型功能高分子材料,是“尿不湿”的主要成分。工业上用丙烯(CH2=CH-CH3)为原料来制备聚丙烯酸钠,请把该合成路线补充完整(无机试剂任选)。_________
是一种新型功能高分子材料,是“尿不湿”的主要成分。工业上用丙烯(CH2=CH-CH3)为原料来制备聚丙烯酸钠,请把该合成路线补充完整(无机试剂任选)。_________