-
化学与日常生活密切相关,下列说法错误的是
A.碘酒是指单质碘的乙醇溶液
B.84消毒液的有效成分是NaClO
C.浓硫酸可刻蚀石英制艺术品
D.装饰材料释放的甲醛会造成污染
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.高温下,0.2mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3
2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
难度: 中等查看答案及解析
-
某同学组装了如图所示的电化学装置电极I为Al,其他电极均为Cu,则
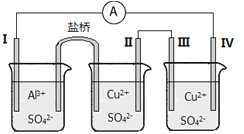
A.电流方向:电极IV→
→电极I
B.电极I发生还原反应
C.电极II逐渐溶解
D.电极III的电极反应:Cu2++2e-==Cu
难度: 中等查看答案及解析
-
已知X、Y、Z为短周期主族元素,在周期表中的相应位置如图所示,下列说法不正确的是( )

A.若X为金属元素,则其与氧元素形成的化合物中阴阳离子个数比可能是1∶2
B.若Z、Y能形成气态氢化物,则稳定性一定是ZHn>YHn
C.若Y是金属元素,则其氢氧化物既能和强酸反应又能和强碱反应
D.三种元素的原子半径:r(X)>r(Y)>r(Z)
难度: 中等查看答案及解析
-
常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
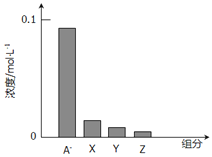
A.HA是强酸
B.该混合液pH=7
C.图中x表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
难度: 中等查看答案及解析
-
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中K+、Fe2+、C6H5OH、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3++2I-
Fe2++I2
C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO42—+Ba2++3OH-
Fe(OH)3↓+ BaSO4↓
D.1 L0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
难度: 中等查看答案及解析
-
茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是

A.将茶叶灼烧灰化,选用①、②和⑨
B.用浓硝酸溶解茶叶并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到滤液,选用④、⑤和⑦
D.检验中滤液中的Fe3+,选用③、⑧和⑩
难度: 中等查看答案及解析
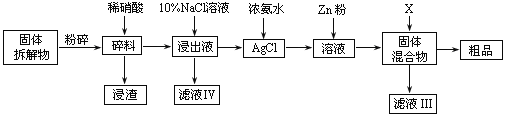
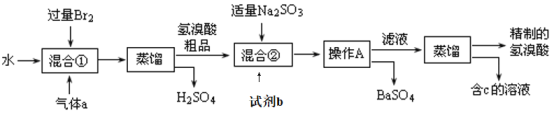
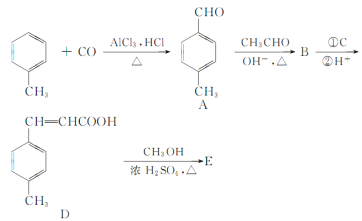
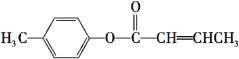 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为___。
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为___。