-
下列指定反应的离子方程式正确的是( )
A.将铜插入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
难度: 中等查看答案及解析
-
通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6 kJ·mol-1
②焦炭与水反应制氢:C(s)+ H2O(g)=CO(g)+ H2(g) ΔH2=+131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g) ΔH3=+206.1 kJ·mol-1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)=C(s)+2H2(g)的ΔH=+74.8 kJ·mol-1
难度: 中等查看答案及解析
-
过氧化钠具有强氧化性,遇木炭、铝粉等还原性物质时可燃烧。下列有关说法不正确的是( )
A.Na2O2与CO2反应时,Na2O2是氧化剂,CO2是还原剂
B.1mol过氧化钠中阴离子数目为NA
C.过氧化钠与木炭、铝粉反应时,过氧化钠均表现出强氧化性
D.过氧化钠与二氧化硫反应时可生成硫酸钠
难度: 简单查看答案及解析
-
化学与生活密切相关。下列说法错误的是
A.泡沫灭火器可用于一般的灭火,也适用于电器灭火
B.疫苗一般应冷藏存放,以避免蛋白质变性
C.家庭装修时用水性漆替代传统的油性漆,有利于健康及环境
D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
难度: 简单查看答案及解析
-
下列各组物质的熔点均与所含化学键的键能有关的是
A. CaO与CO2 B. NaCl与HCl C. SiC与SiO2 D. Cl2与I2
难度: 中等查看答案及解析
-
在容积为1L的密闭容器里,装有4molNO2,在一定温度时进行下面的反应:2NO2(g)
N2O4(g),该温度下反应的平衡常数K=0.25,则平衡时该容器中NO2的物质的量为 ( )
A.0mol B.1mol C.2mol D.3mol
难度: 简单查看答案及解析
-
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
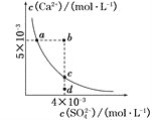
A.在任何溶液中,c(Ca2+)、c(SO42-)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol/L
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
难度: 中等查看答案及解析
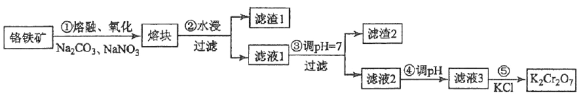
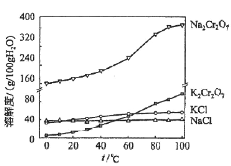
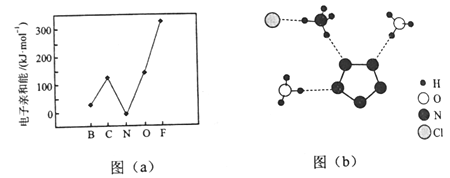
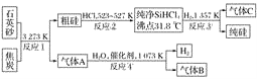

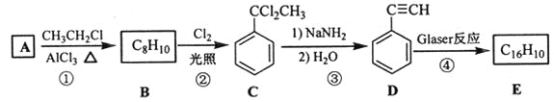
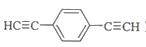 )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。