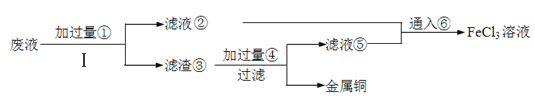
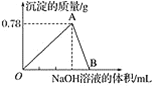
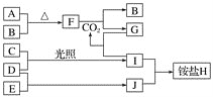
-
以下有关氨及铵盐的叙述中,不正确的是( )
A.铵态氮肥不能与碱性物质如草木灰混合施用
B.氨的喷泉实验体现了氨的溶解性和氧化性
C.实验室里常用固体氯化铵与氢氧化钙反应制取少量氨气
D.氨具有还原性,一定条件下可与氧化性的物质如氧气发生反应
难度: 中等查看答案及解析
-
已知X2、Y2、Z2、W2四种物质的氧化能力为W2>Z2>X2>Y2,下列氧化还原反应能发生的是( )
A.2NaW+Z2==2NaZ+W2 B.2NaZ+X2==2NaX+Z2
C.2NaW+Y2==2NaY+W2 D.2NaX+Z2==2NaZ+X2
难度: 中等查看答案及解析
-
下列各组变化中,只有加入酸才能一步实现的是( )
A. Zn→ZnSO4 B. CuO→CuCl2
C. CaCO3→CO2 D. NaOH→Na2SO4
难度: 中等查看答案及解析
-
四氯化硅(SiCl4)是制造半导体材料硅的中间原料,在空气中容易吸收水蒸气生成原硅酸(H4SiO4)和氯化氢而产生白色烟雾,下列说法正确的是( )
A.由四氯化硅转化为原硅酸的过程中,硅元素化合价发生了改变
B.原硅酸与硅酸中硅元素化合价不同
C.原硅酸与硅酸分别对应的酸性氧化物不同
D.四氯化硅应密封保存
难度: 简单查看答案及解析
-
某无色透明溶液中,能大量共存的离子组是( )
A.Cu2+、Na+、SO42-、Cl﹣ B.Ba2+、Na+、OH﹣、SO42-
C.OH﹣、HCO3﹣、Ca2+、Na+ D.K+、Na+、OH﹣、NO3﹣
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu
B.稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑
C.氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-=BaSO4↓
D.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
难度: 中等查看答案及解析
-
只能用焰色反应才能鉴别的一组物质是( )
A. NaCl、CuCl2 B. NaCl、Na2CO3 C. Na2CO3、K2CO3 D. NH4Cl、Ba(NO3)2
难度: 简单查看答案及解析
-
德国科学家日前利用卫星数据和一种先进的仪器,绘制了一幅地球上空二氧化氮的分布图。从科学家绘制的二氧化氮分布图看,欧洲和北美洲的一些经济比较发达,注重环保的大城市上空二氧化氮密度很高。其原因是这些地区的( )
A.硝酸工业发达
B.雷雨天气较多
C.机动车辆过多
D.燃料以煤为主
难度: 简单查看答案及解析
-
一定条件下硝酸铵受热分解的化学方程式(未配平)为:NH4NO3- HNO3+N2+H2O,在反应中被氧化与被还原的氮原子数之比为:
A.5∶3 B.5∶4 C.1∶1 D.3∶5
难度: 中等查看答案及解析
-
下列变化一定需要加入还原剂才能实现的是( )
A.HCO3-→CO2 B.HCl→Cl2 C.KClO3→KCl D.MnO4-→Mn2+
难度: 中等查看答案及解析
-
铁粉在高温下可与水蒸气反应。若反应后得到的干燥固体质量比反应前铁粉的质量增加了32g。则参加反应的铁粉的物质的量是( )
A.0.5mol B.1mol C.1.5mol D.2mol
难度: 中等查看答案及解析
-
今有一种固体化合物X,X本身不导电,但熔融状态或溶于水中均能够电离,下列关于X的说法中,正确的是( )
A.X一定为电解质 B.X可能为非电解质
C.X只能是盐类 D.X只能是碱类
难度: 简单查看答案及解析
-
完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl﹣,消耗等物质的量浓度的AgNO3溶液的体积比为1∶1∶1,则上述溶液的体积比为
A. 1∶1∶1 B. 6∶3∶2 C. 3∶2∶1 D. 9∶3∶1
难度: 简单查看答案及解析
-
用NA代表阿伏加德罗常数,下列说法中不正确的是( )
A.0.2mol水中含有的氢原子数为0.2NA
B.0.5mol 水分子含有的电子数为5NA
C.1mol镁在化学反应中失去的电子数为2NA
D.1molNO2和N2O4的混合物含有的分子总数为NA
难度: 中等查看答案及解析
-
等质量的下列物质所含分子数最多的是( )
A. N2 B. HCl C. O2 D. NH3
难度: 中等查看答案及解析
-
下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有
B.某溶液中加
溶液生成白色沉淀,说明原溶液中有
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有
D.某溶液中加稀硫酸溶液生成无色无味气体,说明原溶液中有
难度: 中等查看答案及解析
-
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O。据此,下列说法不正确的( )
A.KClO3发生还原反应
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.每生成1 mol ClO2,转移的电子数约为6.02×1023
难度: 中等查看答案及解析
-
常温下,在溶液中能发生如下反应:①2A2++B2=2A3++2B﹣;②16H++10Z﹣+2XO4-=2X2++5Z2+8H2O;③2B﹣+Z2=B2+2Z﹣,由此判断下列说法错误的是
A.Z2+2A2+=2A3++2Z﹣反应可以进行
B.Z元素在②③反应中均被还原
C.氧化性由强到弱的顺序是XO4-、Z2、B2、A3+
D.还原性由强到弱顺序是A2+、B﹣、Z﹣、X2+
难度: 中等查看答案及解析
-
我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9m)恢复了磁性。“钴酞菁”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似。下列说法中不正确的是( )
A.“钴酞菁”分子所形成的分散系具有丁达尔效应
B.“钴酞菁”分子不能透过滤纸
C.此项工作可以用来改变分子的某些物理性质
D.此项工作可广泛应用于光电器件、生物技术等方面
难度: 简单查看答案及解析
-
下列关于“容量瓶及其使用”的叙述中正确是( )
A.用容量瓶配制溶液前应将其干燥
B.用容量瓶配制溶液前应用欲配制的溶液润洗
C.容量瓶可用来长期贮存溶液
D.容量瓶不能用作溶解固体、稀释浓溶液的容器
难度: 简单查看答案及解析
-
一定条件下,钠与氢气化合生成氢化钠(NaH),该化合物能与水反应生成氢氧化钠和氢气。下列关于氢化钠与水反应的说法不正确的是( )
A.氢化钠是还原剂,水是氧化剂 B.氢气既是氧化产物又是还原产物
C.2mol氢化钠反应时可生成1mol氢气 D.反应中1 mol水可得到1mol电子
难度: 中等查看答案及解析
-
在物质分类中,前者包括后者的是
A.氧化物、化合物 B.盐、电解质
C.溶液、胶体 D.分散系、溶液
难度: 简单查看答案及解析
-
用硫酸铜晶体配制500mL0.1mol/L的硫酸铜溶液,需要硫酸铜晶体的质量为
A.25g B.12.5g C.6.25g D.37.5g
难度: 简单查看答案及解析
-
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH
2K2FeO4+6KCl+8H2O,下列有关该反应说法正确的是( )
A.钾元素化合价降低 B.Fe(OH)3发生氧化反应
C.该反应是置换反应 D.Cl2是还原剂
难度: 中等查看答案及解析