-
关于新型冠状病毒,下来说法错误的是
A.该病毒主要通过飞沫和接触传播 B.为减少传染性,出门应戴好口罩
C.该病毒属于双链的DNA病毒,不易变异 D.该病毒可用“84消毒液”进行消毒
难度: 简单查看答案及解析
-
阿伏伽德罗常量的值,最早由奥地利化学及物理学家Johann JosefLoschmidt测得,有时候用上代替NA表示阿伏伽德罗常量的值,下来说法错误的是
A.1.1 g的11B中,含有0.5 NA个质子
B.pH=1的H3PO4溶液中,含有0.1 NA个H+
C.标准状态下的33.6 L氯气与27 g铝充分反应,转移电子数为3NA
D.1 L 1 mol/L NaCl溶液和1 L 1 mol/L NaF溶液中离子总数:前者大于后者
难度: 中等查看答案及解析
-
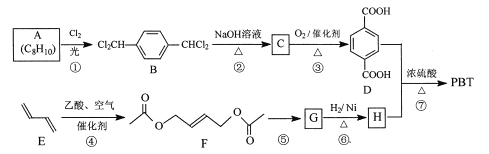
化合物
(a)、
(b)、
(c)同属于薄荷系有机物,下列说法正确的是
A.a、b、c 都属于芳香族化合物 B.a、b、c都能使溴水褪色
C.由a生成c的反应是氧化反应 D.b、c互为同分异构体
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层只有一个电子,Z位于元素周期表IIIA族,W与X属于同一主族。下列说法不正确的是
A.对应简单离子原子半径:r(W)>r(Y)>r(Z)
B.由X、Y组成的化合物中可能含有含共价键
C.Y的最高价氧化物的水化物的碱性比Z的弱
D.X的简单气态氢化物的热稳定性比W的强
难度: 中等查看答案及解析
-
实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是( )
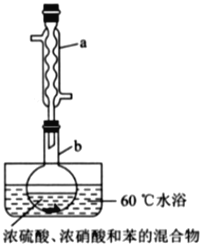
A.水浴加热的优点为使反应物受热均匀、容易控制温度
B.浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加入浓硫酸,待冷却至室温后,再将所得混合物加入苯中
C.仪器a的作用是冷凝回流,提高原料的利用率
D.反应完全后,可用仪器a、b蒸馏得到产品
难度: 中等查看答案及解析
-
我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:
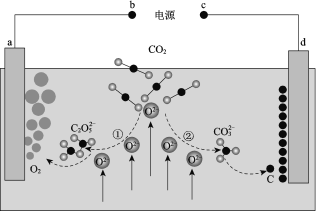
下列说法不正确的是
A. b为电源的正极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极的电极反应式为2C2O52− − 4e− == 4CO2 + O2
D. 上述装置存在反应:CO2 ===== C + O2
难度: 困难查看答案及解析
-
常温下,用NaOH溶液滴定H2C2O4溶液,溶液中-lg[c(H+)/c(H2C2O4)]和-lgc(HC2O4-)或-lg[c(H+)/c(HC2O4-)]和-lgc(C2O42-)关系如图所示,下列说法错误的是( )
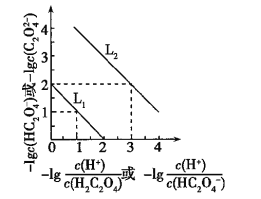
A. Ka1(H2C2O4)=1×10-2
B. 滴定过程中,当pH=5时,C(Na+)-3C(HC2O4-)>0
C. 向1 mol/L的H2C2O4溶液中加入等体积等浓度的NaOH溶液,完全反应后显酸性
D. 向0.1 mol/L的H2C2O4溶液中加水稀释,C(HC2O4-)/C(H2C2O4)比值将增大
难度: 困难查看答案及解析
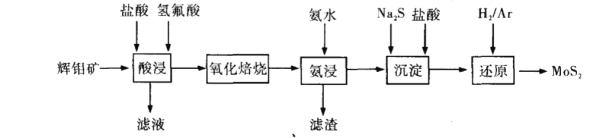
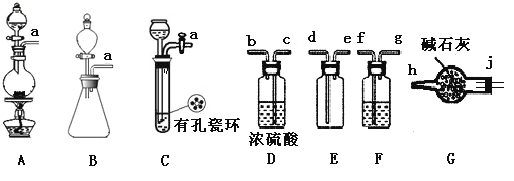
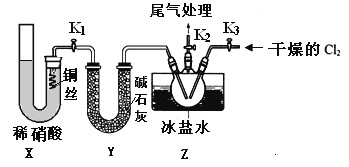
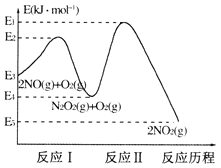
 。
。