-
明矾KAl(SO4)2.12H2O]在造纸等方面应用广泛。实验室中采用废易拉罐(含有Al和少量Fe、Mg杂质)制备明矾的流程如图所示:
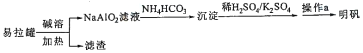
下列叙述错误的是
A. 回收处理废易拉罐有利于保护环境和资源再利用
B. “沉淀”为Al2(CO3)3
C. “操作a”中包含蒸发浓缩、冷却结晶
D. 上述流程中可用过量CO2代替NH4HCO3
难度: 中等查看答案及解析
-
下列有关有机物的描述正确的是( )
A.淀粉、油脂、氨基酸在一定条件下都能水解
B.石油的分馏、煤的液化与气化都是物理变化
C.甲烷与氯气混合光照后,气体颜色变浅,容器内出现油状液滴和白雾
D.苯甲酸的结构简式为
,官能团为羧基和碳碳双键
难度: 中等查看答案及解析
-
设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4L的H2和22.4L的F2气混合后,气体分子数为2 NA
B.30g乙酸和葡萄糖混合物中的氢原子数为2NA
C.常温下pH=12的NaOH溶液中,水电离出的氢离子数为10-12 NA
D.标准状况下,2.24LC2H6含有的共价键数为0.6 NA
难度: 中等查看答案及解析
-
X、Y、Z、W和R为原子序数依次增大的五种短周期主族元素。已知X元素的原子半径在周期表的所有元素中是最小的,Y、R同主族,且R原子的核电荷数是Y原子的核电荷数的2倍,Z、W原子的最外层电子数之和与Y、R原子的最外层电子数之和相等。下列有关说法中正确的是
A.R的氧化物对应的水化物均为强酸
B.简单气态氢化物的热稳定性:Y>Z
C.Y与X、W、R三种元素均可以形成两种二元化合物
D.原子半径由大到小的顺序:W>R>Z>Y>X
难度: 简单查看答案及解析
-
根据下列实验及其现象,所得出的结论合理的是( )
选项
实验
现象
结论
A
用pH试纸分别检验等浓度Na2CO3溶液和Na2SO3溶液
前者试纸变蓝比后者更深些
非金属性:S>C
B
向MgCl2溶液中加入NaOH溶液
生成白色沉淀
碱性:NaOH>Mg(OH)2
C
向某钠盐中滴加盐酸,产生的气体通入品红溶液
品红溶液褪色
该钠盐为Na2SO3或
NaHSO3
D
向有机物X中滴入酸性KMnO4溶液
KMnO4溶液紫色褪去
X不一定能发生加成反应
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
利用如图所示装置,以NH3作氢源,可实现电化学氢化反应。下列说法错误的是
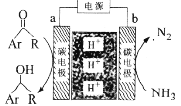
A.a为阴极
B.b电极反应为:2NH3-6e-=N2+6H+
C.电解一段时间后,装置内H+数目增多
D.理论上每消耗1 mol NH3,可生成1.5mol
难度: 中等查看答案及解析
-
常温下,现有0.1 mol/L的NH4HCO3溶液,pH =7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是
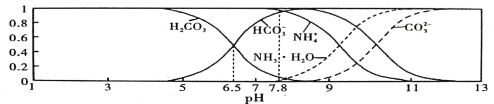
A. 常温下Kb(NH3·H2O)> Kal(H2CO3)
B. 向pH =6.5的上述溶液中逐滴滴加NaOH溶液时,NH4+和HCO3一浓度都逐渐减小
C. NH4HCO3溶液中存在下列守恒关系:c( NH4+) +c( NH3·H2O) =c(HCO3-)+c(CO3 2-)+c( H2 CO3)
D. 当溶液的pH =9时,溶液中存在下列关系:c(HCO3-)>c(NH4+>c(NH3·H2O)>c(CO3 2-)
难度: 中等查看答案及解析
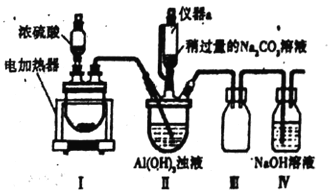
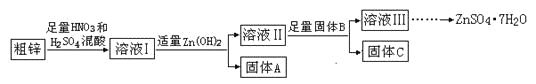
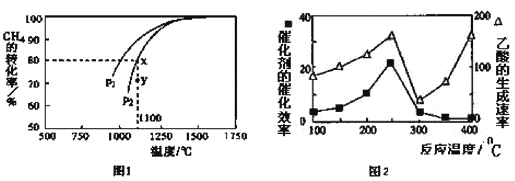
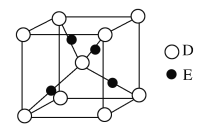
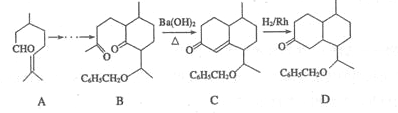
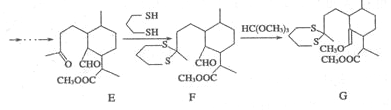
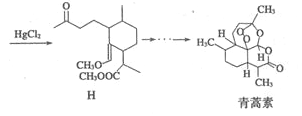
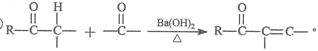
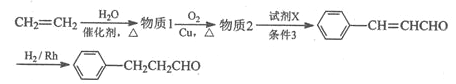
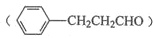 的合成路线流程图。
的合成路线流程图。