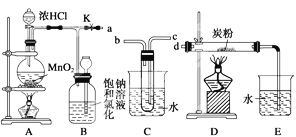
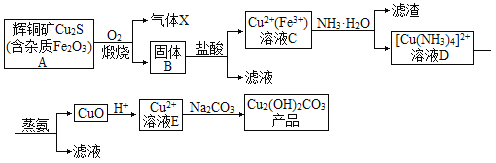
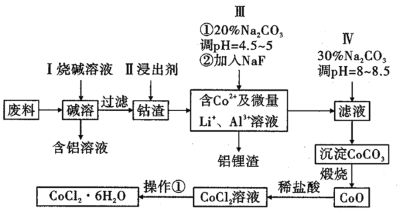
-
2017年1月,南京理工大学胡炳成教授团队成功合成世界首个全氮阴离子盐,全氮阴离子化学式为N5-。下列关于全氮阴离子盐的说法正确的是
A. 每个N5-含有26个电子
B. N5-的摩尔质量为71g·mol-1
C. 全氮阴离子盐既含离子键又含共价键
D. 全氮阴离子盐可能属于电解质,也可能属于非电解质
难度: 中等查看答案及解析
-
下列离子方程式正确的是 ( )
A.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3- =3Fe3++NO↑+3H2O
B.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
C.向Fe(NO3)3溶液中加入过量的HI溶液:2NO3-+8H++6I- =3I2+2NO↑+4H2O
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3 =2FeO42-+3Cl-+H2O+4H+
难度: 中等查看答案及解析
-
将过量的CO2分别通入①CaCl2溶液,②Ca(OH)2溶液,③饱和Na2CO3溶液,最终有白色浑浊出现的是( )
A. 只有③ B. ②③ C. 只有② D. ①②③
难度: 中等查看答案及解析
-
下列有关说法不正确的是( )
A. 南朝·《竹林七贤与启荣期》砖画的砖块的主要成分是硅酸盐
B. 《本草纲目》中“凡酸坏之酒,皆可蒸烧”,该实验方法可用于分离乙酸和乙酸乙酯
C. 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢是铁的合金
D. 《本草经集注》中“以火烧之,紫青烟起,乃真硝石也”,对硝酸钾的鉴定过程中利用了硝酸钾的化学性质
难度: 中等查看答案及解析
-
绿色化学实验是在绿色化学思想指导下的实验新方法,以减少污染,防止浪费等。下列符合绿色化学实验的是( )
A. 用铜与浓硫酸反应制取CuSO4,并用少量品红溶液吸收尾气
B. 将CO还原Fe2O3后的尾气直接排入空气中
C. 用CCl4完成萃取操作实验时,将溴水改成碘水
D. 将Zn和稀硫酸制H2后的废液倒入水槽后再清洗玻璃仪器
难度: 简单查看答案及解析
-
2013年3月,黄浦江上游水质污染较为严重,相关自来水厂采用多种方法并用的方式进行水质处理,下列说法中错误的是( )
A. 加活性炭可吸附水中小颗粒,净化水质的方法属于物理方法
B. 加臭氧对水进行消毒,利用了臭氧的氧化性
C. 用细菌与酶的扩充法去除水中的氨氮的方法属于生物法
D. 用聚合硫酸铁作为净水剂,该处理过程中仅发生了化学变化
难度: 中等查看答案及解析
-
下列关于碳和碳的化合物的说法不正确的是( )
A. 过多CO2排放会导致“温室效应”,应提倡“低碳生活”
B. 一氧化碳易与血液中的血红蛋白结合
C. 金刚石和石墨都是碳单质,但原子排列方式不同,物理性质也不同
D. 锅炉中水垢的主要成分为CaCO3和MgCO3
难度: 中等查看答案及解析
-
下列有关叙述正确的是 ( )
A. 0.2mol·L-1NaCl溶液与0.1mol·L-1Na2CO3溶液中Na+的物质的量相同
B. 1molNa分别生成Na2O或Na2O2,失去的电子数之比为2∶1
C. 等质量的乙酸和葡萄糖充分燃烧消耗O2的分子数相同
D. 1.8gH2O与2.24LNH3含有的电子数相同
难度: 中等查看答案及解析
-
海水的综合利用一直是研究课题。某地天然海水(主要含Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子),研究用海水吸收燃煤排放的含有SO2烟气的工艺流程如图所示,下列说法中正确的是
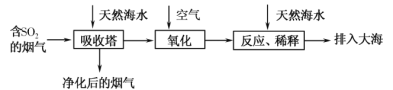
A.工艺中天然海水显酸性
B.氧化过程中可能发生的离子反应为2SO2+2H2O+O2=4H++2SO42-
C.排入大海的溶液与天然海水相比,只有SO42-数量发生了变化
D.若将氧化后的液体进行蒸发结晶,得到的晶体中CaSO4含量最高
难度: 中等查看答案及解析
-
下列离子方程式的书写及评价均正确的是( )
选项
离子方程式
评价
A
将1molCl2通入到含1molFeI2溶液中:
2Fe2++2I﹣+2Cl2═2Fe3++4Cl﹣+I2
正确;Cl2过量,可将Fe2+、I﹣均氧化
B
1mol•L﹣1的NaAlO2溶液和2.5 mol•L﹣1的HCl溶液等体积互相均匀混合:
2AlO2﹣+5H+═Al3++Al(OH)3↓+H2O
正确;AlO2﹣与Al(OH)3消耗的H+的物质的量之比为2:3
C
过量SO2通入到NaClO溶液中:
SO2+H2O+ClO﹣═HClO+HSO3﹣
正确;说明酸性:H2SO3强于HClO
D
Ca(HCO3)2溶液与足量的NaOH溶液反应:Ca2++HCO3﹣+OH﹣═CaCO3↓+H2O
正确;酸式盐与碱反应生成正盐和水
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
下列制取Cl2,用其氧化含I-废液,回收并提纯I2的装置和原理能达到实验目的的是( )
A. 制取Cl2
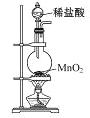 B. 氧化碘离子
B. 氧化碘离子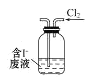
C. 过滤出粗碘
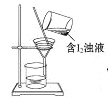 D. 升华提纯碘
D. 升华提纯碘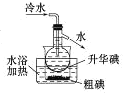
难度: 中等查看答案及解析
-
在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 mol铁粉,充分搅拌后铁完全反应,同时析出0.1 mol Ag。则下列结论中不正确的是
A. 向反应后的溶液中继续加入少量铁粉,铁粉可以继续溶解
B. 氧化性:Ag+>Fe3+>Cu2+>Zn2+
C. 反应后溶液的质量减轻
D. 反应后溶液中Cu2+与Fe2+的物质的量之比为1∶1
难度: 中等查看答案及解析
-
钯的化合物PdCl2通过化学反应可用来检测有毒气体CO,该反应的反应物与生成物有CO、Pd、H2O、HCl、PdCl2和一种未知物质X。下列说法错误的是( )
A. 未知物质X为CO2,属于氧化产物
B. 每转移1 mol e-时,生成2 mol X
C. 反应中PdCl2作氧化剂,被还原
D. 还原性:CO>Pd
难度: 中等查看答案及解析
-
等体积的两份稀酸溶液,一份为amol.L- 1的硝酸溶液;另一份为硝酸和硫酸的混合溶液,硝酸浓度为amol.L- 1 ,硫酸的浓度为bmol.L- 1。若分别向两份溶液加入过量的铜粉,产生的气体体积为1: 2(都只生成NO),则a : b的值是( )
A. 1: 2 B. 3: 2 C. 2: 1 D. 1: 4
难度: 困难查看答案及解析
-
某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+7种离子中的某几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
已知:5Cl2+I2+6H2O=10HCl+2HIO3
据此可以判断:该溶液肯定不存在的离子组是
A.Al3+、Mg2+、SO32- B.Mg2+、CO32-、I-
C.Al3+、SO32-、I- D.Al3+、Br-、SO32-
难度: 困难查看答案及解析
-
铜有两种常见的氧化物CuO和Cu2O。某学习小组取0.98 g(用精密天平测量)Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示;另外,某同学绘制了三条表示金属氧化物与其所含金属元素质量的关系曲线,如图2所示。则下列分析正确的是( )
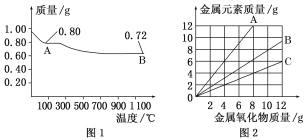
A. 图1中,A到B的过程中有0.005 mol电子发生了转移
B. 图1整个过程中共生成0.18 g水
C. 图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是A
D. 图1中A和B化学式分别为Cu2O和CuO
难度: 中等查看答案及解析