-
下列说法正确是
A.“榆荚只能随柳絮,等闲缭乱走空园”中“柳絮”的主要成分为蛋白质
B.“纷纷灿烂如星陨,赫赫喧雁似火攻”中烟花是某些金属的焰色反应,属于化学变化
C.向蛋清中加入饱和(NH4)2SO4,蛋白质的溶解度减小
D.我国自主研制的新型航天服面料的主要化学成分是由碳化硅陶瓷和碳纤维复合而成的,它属于有机高分子化合物
难度: 中等查看答案及解析
-
设 NA 为阿伏加德罗常数的值,下列说法错误的是( )
A.标准状况下,80g SO3 所含的原子数为 4NA
B.过氧化钠与水反应时,生成 0.1molO2 转移的电子数为 0.2NA
C.1mol N2、3mol H2 混合反应,当生成 0.1mol NH3 时,转移电子数目为 0.3NA
D.100mL 0.1mol•L-1 的 Na2S 溶液,含有的阴离子数目为 0.01NA
难度: 中等查看答案及解析
-
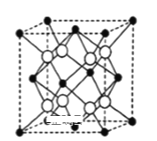
化合物如图的分子式均为C7H8。下列说法正确的是

A.W、M、N均能与溴水发生加成反应 B.W、M、N的一氯代物数目相等
C.W、M、N分子中的碳原子均共面 D.W、M、N均能使酸性KMnO4溶液褪色
难度: 中等查看答案及解析
-
下列说法正确的是
选项
实验目的
所选主要仪器(铁架台等忽略)
部分操作
A
用浓硫酸配制480mL0.1mol/L硫酸溶液
500mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管
将量取好的浓硫酸放入容量瓶中,加水溶解至刻度线
B
从食盐水中得到NaCI晶体
坩埚、酒精灯、玻璃棒、泥三角、三角架
当加热至大量固体出现时,停止加热,利用余热加热
C
分离甲醇和甘油的混合物
蒸馏烧瓶、酒精灯、温度计、直形冷凝管、锥形瓶、牛角管
温度计水银球插入混合液液面以下
D
用CCl4萃取溴水中的Br2
分液漏斗、烧杯
分离时下层液体从分液漏斗下口放出,上层液体从上口倒出
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
X、Y、M、N是短周期主族元素,且原子序数依次增大。已知X原子的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大。下列说法正确的是
A.Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同
B.气态氢化物的热稳定性:M>N
C.M与X的化合物对应的水化物一定是强酸.
D.离子半径
难度: 中等查看答案及解析
-
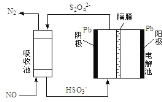
传统接触法制取硫酸能耗大,污染严重。将燃料电池引入 硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能 以燃料电池为电源电解硫酸铜溶液的工作原理示意图如下所示。下列说法不正确的是( )
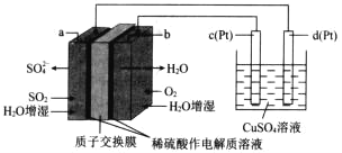
A.若 a 极消耗 2.24LSO2,理论上 c 极有 6.4g 铜析出
B.H+由 a 极通过质子交换膜向 b 极移动
C.该燃料电池的总反应式为 2SO2+O2+2H2O=2H2SO4
D.b 极为正极,电极反应式为 O2+4H++4e-=2H2O
难度: 中等查看答案及解析
-
25℃时,用0.100 mol·L-1盐酸分别滴定20.00 mL 0.100 mol·L-1的氨水和20.00 mL 0.100 mol·L-1NaOH溶液,两溶液的pH与所加盐酸体积(V)的关系如图所示。下列说法正确的是 ( )
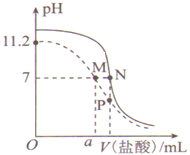
A.Kb(NH3·H2O)的数量级为10—4
B.10 < a < 20
C.P点溶液中:c(NH4+)>c(Cl一)
D.水的电离程度:M > N > P
难度: 中等查看答案及解析