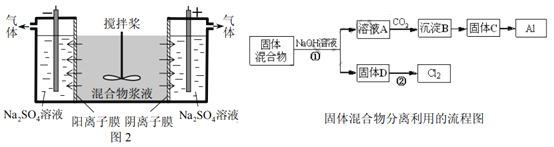
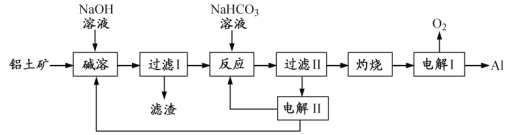
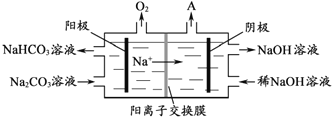
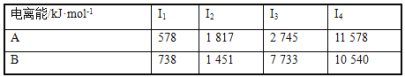
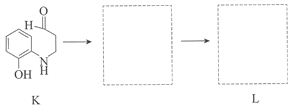
-
短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素。下列说法正确的是
A.原子半径:r(X) < r(Y) < r(Z) < r(W)
B.W的最高价氧化物的水化物是一种弱碱
C.Y的单质的氧化性比Z的强
D.X、Y、Z 三种元素可以组成共价化合物和离子化合物
难度: 中等查看答案及解析
-
能证明乙酸是弱酸的实验事实是
A. CH3COOH溶液与Zn反应放出H2
B. 0.1 mol/L CH3COONa溶液的pH大于7
C. CH3COOH溶液与NaCO3反应生成CO2
D. 0.1 mol/L CH3COOH溶液可使紫色石蕊变红
难度: 中等查看答案及解析
-
下列说法正确的是
A. 氢氧燃料电池放电时化学能全部转化为电能
B. 反应4Fe(s)+3O2(g)
2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C. 3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D. 在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
难度: 中等查看答案及解析
-
我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na
2Na2CO3+C。下列说法错误的是( )
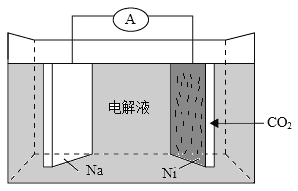
A.放电时,ClO4-向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为:3CO2+4e-=2CO32-+C
D.充电时,正极反应为:Na++e-=Na
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.钠与水反应:Na +2H2O=Na++2OH–+H2↑
B.电解饱和食盐水获取烧碱和氯气:2Cl–+2H2O
H2↑+Cl2↑+2OH–
C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH–+H++SO42-=BaSO4↓+H2O
D.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH–=CaCO3↓+H2O
难度: 中等查看答案及解析
-
苹果醋是一种由苹果发酵而形成的具有解毒、降脂、减肥等明显药效的健康食品。苹果酸(2-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为
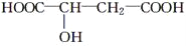 ,下列相关说法不正确的是( )
,下列相关说法不正确的是( )A. 苹果酸在一定条件下能发生酯化反应
B. 苹果酸在一定条件下能发生催化氧化反应
C. 苹果酸能与钠、镁等活泼金属发生置换反应生成H2
D. 1mol苹果醋与Na2CO3溶液反应一定消耗2molNa2CO3
难度: 中等查看答案及解析
-
下列反应在常温下均为非自发反应,在高温下仍为非自发反应的是
A. Ag2O(s)===2Ag(s)+
O2(g)
B. Fe2O3(s)+
C(s)===2Fe(s)+
CO2(g)
C. N2O4(g)===2NO2(g)
D. 6C(s)+6H2O(l)===C6H12O6(s)
难度: 中等查看答案及解析