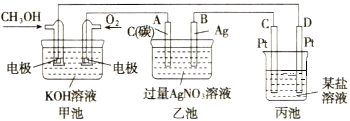
-
下列措施中,能使反应物活化分子数和活化分子百分数都增大的方法是
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂
A. ①③⑤ B. ②⑤ C. ②③⑤ D. ①③④
难度: 中等查看答案及解析
-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A. 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑
B. 氢氧燃料电池的负极反应式:O2 +2H2O+ 4e-=4OH-
C. 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+
D. 钢铁发生电化学腐蚀的正极反应式:Fe-2e-=Fe2+
难度: 中等查看答案及解析
-
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池.①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少.据此判断这四种金属活泼性由大到小的顺序是( )
A.①③②④ B.①③④② C.③④②① D.③①②④
难度: 中等查看答案及解析
-
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A.阳极发生还原反应,其电极反应式:Ni2++2e=Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.铜、石墨均能导电,所以它们均是电解质
B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C.液态HCl、固体NaCl均不能导电,所以HCl、NaCl均是非电解质
D.蔗糖、酒精在水溶液或熔融状态下均不能导电,所以它们均是非电解质
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量
B.热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据
C.书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态
D.凡是化合反应都是放热反应,分解反应都是吸热反应
难度: 简单查看答案及解析
-
S16O2与18O2在高温条件下发生反应2SO2+O2
2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )
A. 只有SO3 B. 只有SO2、SO3 C. 有SO2、SO3、O2 D. 只有O2、SO3
难度: 简单查看答案及解析
-
下列说法正确的是
A.凡是放热反应都是自发的,因为吸热反应都是非自发的
B.自发反应的熵一定增大,非自发反应的熵一定减小
C.常温下,反应C(s)+CO2(g)
2CO(g)不能自发进行,则该反应的ΔH>0
D.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的ΔH>0
难度: 简单查看答案及解析
-
可逆反应mA(s)+nB(g)
cC(g)+fD(g)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如图所示(T2>T1),下列叙述正确的是( )
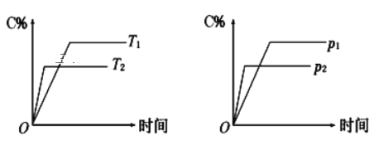
A.达到平衡后,若使用催化剂,C的体积分数增大
B.达到平衡后,若使温度升高,化学平衡向逆反应方向移动
C.化学方程式中n>c+f
D.达到化学平衡后,增加A的量有利于化学平衡向正反应方向移动
难度: 中等查看答案及解析
-
下列关于化学反应速率的说法,不正确的是( )
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.单位时间内某物质的浓度变化大,则该物质反应就快
C.化学反应速率可以用单位时间内生成某物质的质量的多少来表示
D.化学反应速率常用单位有mol·L-1·s-1和mol·L-1·min-1
难度: 简单查看答案及解析
-
用已知物质的量浓度的HCl溶液滴定未知浓度的NaOH溶液时,下列操作会导致测定结果偏小的是( )
①酸式滴定管用蒸馏水洗净后未用待装液润洗
②碱式滴定管用蒸馏水洗净后未用待装液润洗
③滴定前酸式滴定管尖嘴处未充满溶液,滴定至终点时充满溶液
④取碱液时滴定管尖嘴处未充满溶液,取完后充满溶液
⑤锥形瓶用蒸馏水洗净后再用待测液润洗
⑥滴定时摇晃锥形瓶将液体溅出瓶外
⑦滴定过程中,滴定管漏液(未漏入锥形瓶内)
⑧读取标准溶液体积时,滴定前仰视,滴定后俯视
A.②④ B.①③⑤⑦ C.④⑧ D.②④⑥⑧
难度: 中等查看答案及解析
-
用水稀释0.1mol·L-1氨水,溶液中随着水量的增加而增大的是( )
A.
B.
C.
D.c(H+)·c(OH-)
难度: 中等查看答案及解析
-
将H2(g)和Br2(g)充入恒容密闭容器中,恒温条件下发生反应H2(g)+Br2(g)
2HBr(g) ΔH<0,平衡时Br2(g)的转化率为α,若初始条件相同,绝热条件下进行上述反应,平衡时Br2(g)的转化率为β。则α与β的关系是( )
A.α>β B.α=β C.α<β D.无法确定
难度: 中等查看答案及解析
-
用pH试纸测定溶液pH的正确操作是( )
A.将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
B.将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
C.将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照
D.将一小条试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准比色卡对照
难度: 简单查看答案及解析
-
常温下,将pH=4的硫酸溶液分别稀释成原体积的10倍、100倍、10000倍。则稀释后溶液的pH分别为( )
A.5、6、8 B.5、6、7 C.4.7、6.7、8 D.4.7、6.7、7
难度: 中等查看答案及解析
-
H2(g)+F2(g)=2HF(g) H=-270kJmol-1,下列说法正确的是( )
A.2L氟化氢气体分解成1L氢气与IL氟气吸收270kJ热量
B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢的能量
D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270kJ热量
难度: 中等查看答案及解析
-
在室温下,等体积的酸和碱的溶液混合后,pH一定小于7的是
A.pH=3的HNO3和pH=11的KOH溶液
B.pH=3的盐酸和pH=11的氨水
C.pH=3硫酸和pH=11的氢氧化钠溶液
D.pH=3的醋酸和pH=11的氢氧化钡溶液
难度: 中等查看答案及解析
-
用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积变化关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
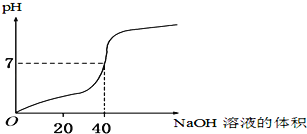
A.1.0 mol/L,20 mL B.0.5 mol/L,40 mL
C.0.5 mol/L,80 mL D.1.0 mol/L,80 mL
难度: 中等查看答案及解析
-
25 ℃时,若pH=a的10体积某强酸溶液与pH=b的1体积某强碱溶液混合后溶液呈中性,则混合之前该强酸的pH与强碱的pH之间应满足的关系为
A.a+b=14 B.a+b=13
C.a+b=15 D.a+b=7
难度: 中等查看答案及解析
-
己知:
与
反应的
;
与
反应的
。则
在水溶液中电离的
等于
A.
B.
C.
D.
难度: 简单查看答案及解析
-
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:
Ni(OH)2+ M = NiOOH+ MH
已知:6NiOOH + NH3+ H2O + OH-=6Ni(OH)2+ NO2-
下列说法正确的是
A.NiMH 电池放电过程中,正极的电极反应式为:NiOOH + H2O + e-= Ni(OH)2 + OH-
B.充电过程中OH-离子从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O + M + e-= MH + OH-,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
难度: 困难查看答案及解析
-
常温下,若1体积硫酸恰好与2体积pH=11的氢氧化钠溶液混合后pH=3(混合后体积变化不计)则二者物质的量浓度之比应为( )
A.5︰1 B.5︰2 C.1︰5 D.2︰5
难度: 中等查看答案及解析
-
一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)
CH3OH(g)达到平衡。下列说法正确的是( )
容器
温度/K
物质的起始浓度mol·L-1
物质的平衡浓度/mol·L-1
c(H2)
c(CO)
c(CH3OH)
c(CH3OH)
Ⅰ
400
0.20
0.10
0
0.080
Ⅱ
400
0.40
0.20
0
Ⅲ
500
0
0
0.10
0.025
A.该反应的正反应放热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的小
难度: 中等查看答案及解析
-
常温下,下列叙述正确的是( )
A.pH值等于5的HCl溶液和PH值等于9的NaOH溶液由水电离出的c(H+)之比为1:1
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.PH=2的HNO3溶液和PH=10的Ba(OH)2溶液等体积混合后的溶液的PH=7
D.向0.1 mol/L的氨水中加入少量醋酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
难度: 简单查看答案及解析
-
pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
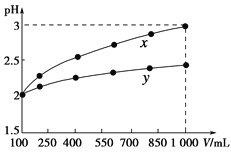
A.x为弱酸,Vx<Vy B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy D.y为强酸,Vx>Vy
难度: 中等查看答案及解析