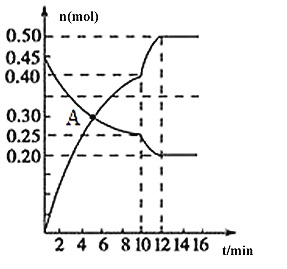
-
能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是
①将水加热煮沸 ②向水中投入一小块金属钠 ③向水中通CO2 ④向水中通NH3 ⑤向水中加入明矾晶体 ⑥向水中加入NaHCO3固体 ⑦向水中加NaHSO4固体
A. ①③⑥⑦ B. ①③⑥ C. ⑤⑦ D. ⑤
难度: 中等查看答案及解析
-
某同学设计如图所示实验,探究反应中的能量变化。
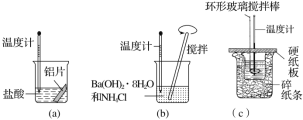
下列判断正确的是( )
A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应
B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加
C.实验(c)中将环形玻璃搅拌棒改为铁质搅拌棒对实验结果没有影响
D.若用NaOH固体测定中和热,则测定中和热的数值偏高
难度: 简单查看答案及解析
-
在一定条件下,反应2SO2(g)+O2(g)
2SO3(g)达到了平衡,改变某一条件,发生下述变化,其中可确定该平衡一定发生移动的是
A. v(SO2)增大 B. v(SO3)减小
C. O2的百分含量发生变化 D. SO3的质量不变
难度: 中等查看答案及解析
-
t ℃时,某浓度氯化铵溶液的pH=4,下列说法中一定正确的是( )
A. 由水电离出的氢离子浓度为10-10 mol·L-1
B. 溶液中c(H+)·c(OH-)=1×10-14
C. 溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D. 溶液中c(NH3·H2O)+c(NH4+)=c(Cl-)+c(OH-)
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列结论中正确的是( )
A.25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA
B.粗铜精炼时,当阳极质量减少6.4g时,电路中转移电子数一定不是0.2NA
C.含0.2molH2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
D.200mL0.5mol/LNa2CO3溶液中,由于CO32-水解,所以阴离子数目小于0.1NA
难度: 中等查看答案及解析
-
下图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
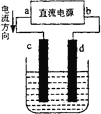
A.a为负极,b为正极 B.a为阳极,b为阴极
C.电解过程中,d电极质量增加 D.电解过程中,氯离子浓度不变
难度: 简单查看答案及解析
-
某温度下,在容积为2 L的密闭容器中发生反应2X(g)+Y(g)
2W(g) ΔH<0,当充入2 mol X和1 mol Y,经20 s达到平衡时生成了0.4 mol W。下列说法正确的是( )
①升高温度,W的体积分数减小,ΔH增大 ②以Y的浓度变化表示的反应速率为0.01 mol·L-1·s-1 ③在其他条件不变的情况下,增加1 mol X,则X和Y的转化率均提高 ④增大压强,正反应速率增大,逆反应速率减小,则平衡向正反应方向移动 ⑤再向容器中通入2 mol X和1 mol Y,达到平衡时,X、Y的转化率均增大
A.⑤ B.①⑤ C.②③④ D.④⑤
难度: 中等查看答案及解析
-
常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:
实验编号
c(HA)/ mol·L-1
c(NaOH)/ mol·L-1
反应后溶液pH
甲
0.1
0.1
pH=9
乙
c1
0.2
pH=7
下列判断不正确的是
A.c1一定大于0.2 mol·L-1
B.HA的电离方程式是HA
H++A-
C.甲反应后溶液中:c(Na+) > c(OH-)> c(A-) > c(H+)
D.乙反应后溶液中:c(Na+) < c(HA)+c(A-)
难度: 中等查看答案及解析
-
下列关于盐类水解的应用中,说法正确的是( )
A. 加热蒸干Na2CO3溶液,最后可以得到NaOH和Na2CO3的混合固体
B. 除去MgCl2中的Fe3+,可以加入NaOH固体
C. 明矾净水的反应:Al3++3H2O
Al(OH)3+3H+
D. 加热蒸干KCl溶液,最后得到KOH固体(不考虑与CO2的反应)
难度: 中等查看答案及解析
-
常温下,用某浓度的NaOH溶液滴定20.00 mL 等浓度的CH3COOH溶液,所得滴定曲线如下图。下列说法正确的是
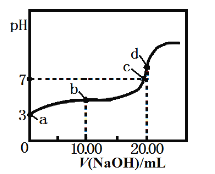
A. a点醋酸的浓度为1.0×10-3mol·L-1
B. a、b 两点对应的醋酸电离平衡常数:a<b
C. c点c(Na+):c(CH3COO-)=1:1
D. d点溶液升高温度,溶液pH不变
难度: 中等查看答案及解析
-
25℃时,将a mol·L-1一元酸HA与b mol·L-1 NaOH等体积混合后测得溶液pH=7,则下列关系一定不正确的是( )
A.a=b B.a>b
C.c(A-)=c(Na+) D.c(A-)<c(Na+)
难度: 困难查看答案及解析
-
化学平衡常数(K)、电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是
A.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
B.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸强
C.向硝酸银溶液中加入同浓度的氯化钠和溴化钠溶液,先产生浅黄色沉淀,则Ksp(AgBr)>Ksp(AgCl)
D.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)变大
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.增大压强,活化分子数增加,化学反应速率一定增大
B.常温下,反应C(s)+CO2 (g)=2CO(g)不能自发进行,则该反应的∆H>0
C.加入反应物,使活化分子百分数增加,化学反应速率一定增大
D.同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照的点燃条件下的∆H不同
难度: 中等查看答案及解析
-
某铅酸蓄电池的工作原理如图所示,其总反应式为
。下列判断不正确的是
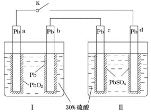
A.闭合K时,d电极的反应式为
B.当电路中转移
电子时,Ⅰ中消耗的
为
C.闭合K时,Ⅱ中
向c电极迁移
D.闭合K一段时间后,Ⅱ可单独作为原电池,d电极为正极
难度: 中等查看答案及解析
-
下列关于盐类水解的说法错误的是( )
A.浓度均为0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为①>②>③
B.pH相等的①NaHCO3、②Na2CO3、③NaOH溶液的物质的量浓度大小:①>②>③
C.在NH4Cl溶液中加入稀HNO3,能抑制NH4+水解
D.将硫酸亚铁溶液加热蒸干得不到原溶质
难度: 中等查看答案及解析
-
已知t ℃时AgCl的Ksp=4×10-10,在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
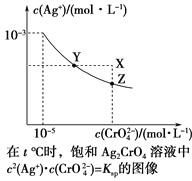
A. 在t ℃时,Ag2CrO4的Ksp为1×10-11
B. 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点
C. 在t ℃,Ag2CrO4(s)+2Cl-(aq)
2AgCl(s)+CrO
(aq)平衡常数K=6.25×107
D. 在t ℃时,以0.001 mol·L-1 AgNO3溶液滴定20 mL 0.001 mol·L-1 KCl和0.001 mol·L-1的K2CrO4的混合溶液,CrO
先沉淀
难度: 中等查看答案及解析
-
常温下,将pH=a的NaOH溶液与pH=b的醋酸溶液等体积混合后,两者恰好完全反应,则该温度下醋酸的电离平衡常数约为
A.1014-a-2b B.10 a+b-14 C.10a-2b D.10a-2b+14
难度: 中等查看答案及解析
-
室温下,向含有AgCl和AgBr固体的悬浊液中加入少量NaBr固体时,下列数值增大的是( )
A.c(Ag+) B.
C.c(Cl-) D.
难度: 简单查看答案及解析
-
下列装置或操作能达到目的的是
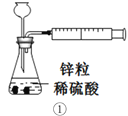
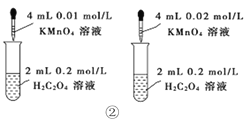
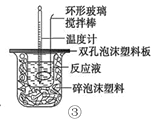
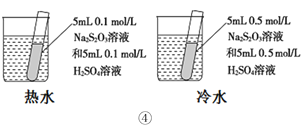
A. 装置①用于测定生成氢气的速率
B. 装置②依据单位时间内颜色变化来比较浓度对反应速率的影响
C. 装置③进行中和反应反应热的测定实验
D. 装置④依据出现浑浊的快慢比较温度对反应速率的影响
难度: 中等查看答案及解析
-
下列溶液中粒子的物质的量浓度关系正确的是( )
A.0.1mol/L NaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)
B.20ml 0.1mol/LCH3COONa溶液与10ml 0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(OH-)
C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+ c(CH3COOH)
难度: 中等查看答案及解析