-
FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液是三种重要的分散系,下列叙述中不正确的是( )
A. Fe(OH)3胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9~10-7米之间
B. 分别用一束光透过三种分散系,只有Fe(OH)3胶体具有丁达尔效应
C. 三种分散系中分散质均属于电解质
D. Fe(OH)3胶体、Fe(OH)3浊液均能与盐酸反应,且反应现象相同
难度: 中等查看答案及解析
-
下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A.H + NO3- Fe 2+ Na + B.Ag + NO3- Cl - K +
C.K + Ba 2+ OH - SO42- D.Cu 2+ NH4+ Br - OH -
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是
A.等物质的量的N2和CO所含分子数均为NA
B.1.7gH2O2中含有的电子数为0.9NA
C.1molNa2O2固体中含离子总数为4NA
D.标准状况下,2.24L戊烷所含分子数为0.1NA
难度: 中等查看答案及解析
-
我国明代《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”“以烧酒复烧二次价值数倍也”。这里用到的实验方法可用于分离( )
A.苯和水 B.乙酸乙酯和乙酸
C.食盐水和泥沙 D.硝酸钾和硫酸钠
难度: 中等查看答案及解析
-
下列有关化学用语的描述不正确的是( )
A. MgF2的电子式:

B. 中子数为15的硅原子:
C. 次氯酸的结构式:H—Cl—O
D. NH3·H2O的电离方程式:NH3·H2O
NH4++OH—
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.SiO2是酸性氧化物,能与水反应
B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液无色
难度: 简单查看答案及解析
-
下列有关物质的性质与应用相对应的是 ( )
A.明矾能水解生成Al(OH)3胶体,可用作自来水消毒剂
B.FeCl3溶液能与Cu反应,可用于蚀刻印刷电路
C.SO2具有氧化性,可用于漂白纸浆
D.浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈红棕色
难度: 简单查看答案及解析
-
在标准状况下有①6.72L CH4,②3.01×1023个HCl分子,③13.6g硫化氢,④0.2mol氨气(NH3)。下列对这四种气体的关系从大到小描述不正确的是( )
A.体积②>③>①>④ B.密度②>③>④>①
C.质量②>③>①>④ D.氢原子数①>④>③>②
难度: 中等查看答案及解析
-
解释下列事实的方程式正确的是( )
A.Al溶于NaOH溶液:Al + H2O + 2OH-=AlO2- + 2H2↑
B.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2 + 2OH-=SiO32- + H2O
C.硫酸铝溶液中加入过量的氨水:Al3++3OH-=Al(OH)3↓
D.铁片放入过量的稀硝酸中:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,11.2 L水中含有分子的数目为0.5NA
B. 100 mL 0.2 mol·L-1的FeCl3溶液中,含Fe3+数为0.02NA
C. 1 mol Cl2与足量的NaOH溶液反应,转移的电子数为1NA
D. 在密闭容器中加入0.5 mol N2和1.5 mol H2,充分反应后可得到NH3分子数为NA
难度: 中等查看答案及解析
-
下列指定微粒的数目相等的是( )
A.等物质的量的CaCl2和CaO2含有的离子数
B.等温等压下,质子数相等的CO、N2、C2H2三种气体含有的原子数
C.同温、同压、同体积的CO和NO含有的质子数
D.物质的量相同的铁和铝分别与足量氯气完全反应时转移的电子数
难度: 中等查看答案及解析
-
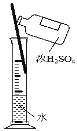
下列四组实验中,操作正确且能达到预期目的是
A.配制稀硫酸
 B.固体NaHCO3分解
B.固体NaHCO3分解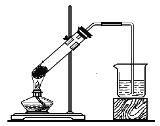
C.制备Fe(OH)2沉淀
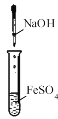 D.收集NH3
D.收集NH3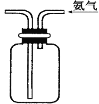
难度: 中等查看答案及解析
-
将碳酸钠和碳酸氢钠的固体混合物Wg溶于水制成500mL溶液,钠离子的物质的量浓度为0.8mol·L-1,若将Wg该混合物用酒精灯加热至质量不再改变时,得到的固体物质的质量可能是
A.21.2g B.6.2g C.8.4g D.10.6g
难度: 中等查看答案及解析