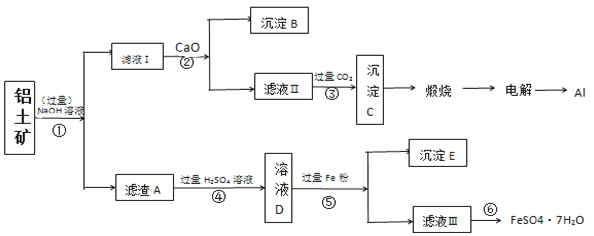
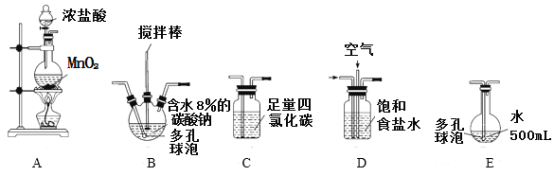
-
改革开放40周年取得了很多标志性成果,下列说法不正确的是
A.“中国天眼”的镜片材料为SiC,属于新型无机非金属材料
B.“蛟龙”号潜水器所使用的钛合金材料具有强度大、密度小、耐腐蚀等特性
C.北斗导航专用ASIC硬件结合国产处理器打造出一颗真正意义的“中国芯”,其主要成分为SiO2
D.港珠澳大桥设计使用寿命120年,水下钢柱镶铝块防腐的方法为牺牲阳极保护法
难度: 简单查看答案及解析
-
镁铝合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等,下列与这些用途无关的性质是( )
A.不易生锈 B.导电性好
C.密度小 D.强度高
难度: 简单查看答案及解析
-
下列由相关实验现象所推出的结论正确的是
A. NH4Cl和NH4HCO3受热都能分解,说明可以用加热NH4Cl和NH4HCO3固体的方法制氨气
B. 向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42-
C. Fe 与稀HNO3、稀H2SO4反应均有气泡产生。说明Fe 与两种酸均发生置换反应
D. NH3遇到浓盐酸产生白烟,说明二者发生反应生成白色固体
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是( )
A. 向
溶液中滴加氨水至过量:
B. 向
悬浊液中滴加
溶液:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
C. 向
溶液中加入足量稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
D. 向苯酚钠溶液中通入少量
气体:2C6H5O-+CO2+H2O=2C6H5OH+CO32-
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. Cl2溶于水得到的氯水能导电,但Cl2不是电解质,而是非电解质
B. 以铁作阳极,铂作阴极,电解饱和食盐水,可以制备烧碱
C. 将1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为
D. 反应Al2O3(s)+3Cl2(g)+3C(s)═2AlCl3(g)+3CO(g)室温下不能自发进行,则
难度: 中等查看答案及解析
-
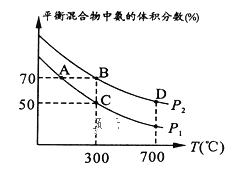
对于可逆反应:2A(g)+B(g)
2C(g) △H<0,下列各图中正确的是
A.
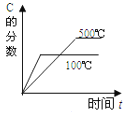
B.
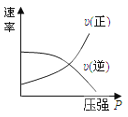
C.
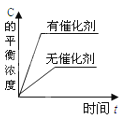
D.
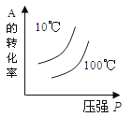
难度: 中等查看答案及解析
-
某温度下,在一个2L的密闭容器中,加入4molA和 2molB进行如下反应:3A(g)+2B(g)
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
A.该反应的化学平衡常数表达式是 K=
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加 B,平衡向右移动,B的平衡转化率增大
难度: 中等查看答案及解析
-
下列溶液中微粒浓度关系一定正确的是
A.氨水与氯化铵的pH=7的混合溶液中:C(Cl-)>C(NH4+)
B.pH=2的一元酸和pH=12的一元强碱等体积混合:C(OH-)=C(H+)
C.O.1mol/L的硫酸铵溶液中:C(NH4+)>C(SO42-)>C(H+)
D.0.1mol/L的硫化钠溶液中:C(OH-)=C(H+)>C(HS-)>C(H2S)
难度: 困难查看答案及解析
-
室温下,若溶液中由水电离产生的c(OH-)=1×10-14 mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
A.Al3+、Na+、NO3-、Cl- B.K+、Na+、Cl-、NO3-
C.K+、Na+、Cl+、AlO2- D.K+、NH4+、SO42-、NO3-
难度: 简单查看答案及解析
-
t℃时,已知PdI2在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
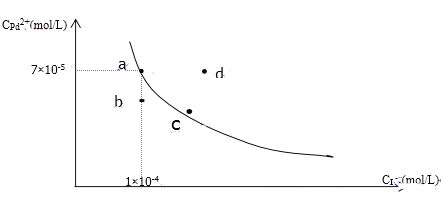
A. 在t℃时PdI2的Ksp=7.0×10-9
B. 图中a点是饱和溶液,b、d两点对应的溶液都是不饱和溶液
C. 向a点的溶液中加入少量NaI固体,溶液由a点向c点方向移动
D. 要使d点移动到b点可以降低温度
难度: 中等查看答案及解析
-
银锌电池广泛用作各种电子仪器的电源,电池反应是:Ag2O+Zn+H2O=2Ag+Zn(OH)2,下列说法正确的是( )
A. 工作时原电池负极附近溶液的pH增大 B. 电子由Zn经过溶液流向Ag2O
C. 溶液中OH- 由Zn电极移向Ag2O电极 D. Ag2O作正极:Ag2O+H2O+2e-=2Ag+ 2OH-
难度: 中等查看答案及解析
-
H2C2O4(草酸)为二元弱酸,在水溶液中H2C2O4、HC2O4-和C2O42-物质的量分数与pH关系如图所示,下列说法不正确的是
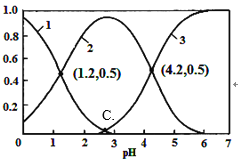
A. 由图可知,草酸的Ka=10-1.2
B. 0.1 mol·L—1NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H+)>c(OH-)
C. 向草酸溶液中滴加氢氧化钠溶液至pH为4.2时c(Na+)+c(H+)=3c(C2 O42-)+c(OH-)
D. 根据图中数据计算可得C点溶液pH为2.8
难度: 中等查看答案及解析
-
常温下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3·H2O) =1.76×10-5,下列说法正确的是
A. 浓度均为0.1 mol·L-1的 HCOONa和NH4Cl溶液中阳离子的物质的量浓度之和:前者大于后者
B. 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C. 0.2 mol·L-1 HCOOH 与 0.1 mol·L-1 NaOH 等体积混合后的溶液中: c(HCOO-) + c(OH-) = c(HCOOH) + c(H+)
D. 0.2 mol·L-1 CH3COONa 与 0.1 mol·L-1盐酸等体积混合后的溶液中(pH<7): c(CH3COOH)> c(Cl- )>c(CH3COO-)>c(H+)
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A.氨水应密闭保存,放置于低温处
B.在硫酸亚铁溶液中,加入铁粉以防止氧化变质
C.生产硝酸的过程中使用过量空气以提高氨气的利用率
D.实验室常用排饱和食盐水的方法收集氯气
难度: 简单查看答案及解析
-
如图所示是一种以液态肼(N2H4)为燃料氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700—900℃时,O2—可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是( )
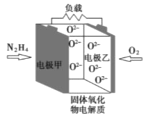
A.电池内的O2—由电极甲移向电极乙
B.电池总反应为N2H4+2O2=2NO+2H2O
C.当甲电极上有1molN2H4消耗时,标况下乙电极上有22.4LO2参与反应
D.电池外电路的电子由电极乙移向电极甲
难度: 中等查看答案及解析