-
下列说法不正确的是( )
A.原子光谱是测定物质结构的基本方法和实验手段
B.霓虹灯能够发出五颜六色的光,其发光机理与氢原子光谱形成机理基本相同
C.原子线状光谱的产生是原子核外电子在不同的、能量量子化的状态之间跃迁所导致的
D.“在高分辨钠原子光谱中的靠的很近的两条黄色谱线”可以利用玻尔原子结构模型较好地解释
难度: 简单查看答案及解析
-
下列能级中,能级符号正确且轨道数为5的是( )
A.2d B.3p C.4d D.5s
难度: 简单查看答案及解析
-
下列粒子的中心原子形成sp3杂化轨道且该粒子的空间构型为三角锥形的是( )
A.SO42- B.CH3- C.ClO2- D.[PCl4]+
难度: 简单查看答案及解析
-
以下是一些同学书写的某些原子的2p能级或3d能级中的电子排布情况,其中违反了洪特规则的是( )
A.
B.
C.
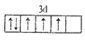 D.
D.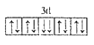
难度: 简单查看答案及解析
-
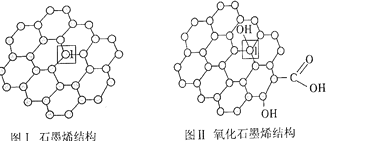
下列说法错误的是( )
A.分子的许多性质与分子的对称性有关
B.石墨晶体具有金属键的特性
C.离子晶体中的化学键可能有方向性和饱和性
D.氯化钠晶体中与Na+距离最近且相等的Na+有6个
难度: 简单查看答案及解析
-
下列说法错误的是( )
A.最外层电子数为2且价电子数为5的元素可能为主族元素
B.外围电子构型为4f75d16s2的元素在周期表中位置应是第六周期
C.最外层电子排布式为ns2的元素可能是金属元素也可能是非金属元素
D.1~36号元素中,基态原子价电子层中未成对电子数最多的元素位于ⅥB族
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.分子晶体的熔点一定比金属晶体的熔点低
B.晶体在受热熔化过程中一定存在化学键的断裂
C.DNA呈双螺旋结构是由于两条链间形成氢键所致
D.根据价电子互斥理论可以分析出NH3、PH3、AsH3、SbH3分子的键角依次变大
难度: 中等查看答案及解析
-
下列关于共价键的说法正确的是( )
A.丙炔分子中含有5个σ键和2个π键
B.乙醇分子中O-H键的极性强于C-H键的极性
C.乙烷分子中只含有极性键不含有非极性键
D.分子晶体中共价键键能越大,该分子晶体的熔点和沸点一定也越高
难度: 中等查看答案及解析
-
下列状态的铝中,电离最外层一个电子所需能量最大的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
由IIIA 族元素A和VIA 族元素B组成的阴离子结构如下:

则所带电荷X、Y、Z依次为多少?
A. 4、4、2 B. 4、3、2 C. 3、3、2 D. 4、2、2
难度: 中等查看答案及解析
-
现有对四种元素的叙述如下:
①元素X的基态原子的价电子排布式3s23p1
②元素Y的基态原子的原子结构示意图
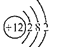
③元素Z的基态原子Z3-的轨道表示式
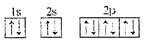
④元素T的基态原子有两个电子层,电子式为
则下列有关比较中正确的是( )
A.第一电离能:T>Z>X>Y
B.简单离子半径:Z>T>Y>X
C.电负性:Z>T>Y>X
D.最高正化合价:T>Z>X>Y
难度: 中等查看答案及解析
-
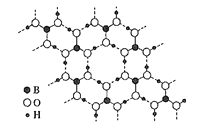
CalanolideA是一种抗HIV药物,其结构简式如图所示。下列关于CalanolideA的说法错误的是( )

A.该物质在水中的溶解度较大
B.分子中有三个手性碳原子
C.CalanolideA可能存在分子内氢键
D.分子中sp2杂化的碳原子和sp3杂化的碳原子数目相同
难度: 中等查看答案及解析