-
“拟晶”(quasicrystal)是一种具有凸多面体规则外形但不同于晶体的固态物质。Al65Cu23Fe12是二十世纪发现的几百种拟晶之一,具有合金的某些优良物理性能。下列有关这种拟晶的说法正确的是
A.无法确定Al65Cu23Fe12中三种金属的化合价
B.Al65Cu23Fe12的硬度小于金属铁
C.Al65Cu23Fe12不可用作长期浸泡在海水中的材料
D.1 mol Al65Cu23Fe12溶于过量的硝酸时共失去265 mol电子
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.升高温度活化能降低
B.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
C.用电解水的方法制取大量氢气可以缓解能源不足的问题
D.推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应
难度: 简单查看答案及解析
-
对H2O的电离平衡不产生影响的粒子是( )
A. HCl B. 13X3+ C. CH3COO- D.
难度: 中等查看答案及解析
-
下列反应能量变化与右图一致的是
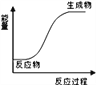
A. 金属钠与水的反应
B. 盐酸与氢氧化钠的反应
C. 铝与氧化铁的铝热反应
D. 电解水制H2和O2
难度: 中等查看答案及解析
-
25℃时,在①0.01mol/L的盐酸,②pH=2的醋酸,③pH=12的氨水,④0.01mol/L的NaOH溶液4种溶液中,由水电离出的c(H+)的大小关系是
A.②>①>④>③ B.①=②=③=④ C.②=③>①=④ D.②<①<③<④
难度: 简单查看答案及解析
-
已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O
CH3COO-+H3O+
K1=1.75×10-5mol·L-1
CH3COO-+H2O
CH3COOH+OH-
K2=5.71×10-10mol·L-1
现将 50 mL 0.2 mol·L-1醋酸与 50 mL 0.2 mol·L-1醋酸钠溶液混合制得溶液甲,下列叙述正确的是
A.溶液甲的pH>7
B.对溶液甲进行微热,K1、K2同时增大
C.若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大
D.若在溶液甲中加入 5 mL 0.1 mol·L-1的盐酸,则溶液中醋酸的 K1 会变大
难度: 简单查看答案及解析
-
反应CH3OH(l)+NH3(g)===CH3NH2(g)+H2O(g)在某温度自发向右进行,若反应的|ΔH|=17kJ·mol-1,|ΔH-TΔS|=17 kJ·mol-1,则下列关系式正确的是( )
A.ΔH>0,ΔH-TΔS<0 B.ΔH<0,ΔH-TΔS>0
C.ΔH>0,ΔH-TΔS>0 D.ΔH<0,ΔH-TΔS<0
难度: 简单查看答案及解析
-
取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )
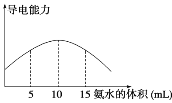
A. 0.5% B. 1.0% C. 0.1% D. 1.5%
难度: 困难查看答案及解析
-
肼(N2H4)在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图。已知200℃时:反应Ⅰ:3N2H4(g)=N2(g)+4NH3(g) ΔH1=−32.9 kJ·mol−1;反应Ⅱ:N2H4(g)+H2(g)=2NH3(g) ΔH2=−41.8kJ·mol−1

下列说法不正确的是
A. 图所示过程①是放热反应
B. 反应Ⅱ的能量过程示意图如图所示
C. 断开3 molN2H4(g)的化学键吸收的能量大于形成1molN2(g)和4molNH3(g)的化学键释放的能量
D. 200℃时,肼分解生成氮气和氢气的热化学方程式为N2H4(g)=N2(g)+2H2(g) ΔH=+50.7 kJ·mol−1
难度: 中等查看答案及解析
-
一定条件下,a L密闭容器中放入1molN2和3molH2发生N2+3H2
2NH3的反应,下列选项中能说明反应已达到平衡状态的是
A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
B.2v(H2)=3v(NH3)
C.单位时间内1个N≡N键断裂的同时,有6个N-H键断裂
D.单位时间消耗0.1molN2的同时,生成0.2molNH3
难度: 中等查看答案及解析
-
在100℃时,把0.5molN2O4通入体积为5L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达平衡,此时容器内压强为开始时的1.6 倍。下列说法正确的是
A.前2s以N2O4的浓度变化表示的平均反应速率为0.01mol·L-1·s-1
B.在2s时体系内的压强为开始时的1.1倍
C.在平衡时体系内N2O4的物质的量为0.25mol
D.平衡时,N2O4的转化率为40%
难度: 中等查看答案及解析
-
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(
),发生反应:
,体系中c(Pb2+)和c(Sn2)变化关系如右图所示。下列判断正确的是

A.往平衡体系中加入少量金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量
固体后,c(Sn2-)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应
D.25℃时,该反应的平衡常数K=2.2
难度: 中等查看答案及解析
-
部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数
(25℃)
K1=1.77×10-4
K1=4.9×10-10
K1=4.3×10-7
K2=5.6×10-11
下列选项正确的是( )
A.2CN- + H2O + CO2 =2HCN + CO32-
B.相同物质的量浓度的溶液的pH:Na2CO3>NaHCO3>NaCN>HCOONa
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.相同温度下,同浓度的酸溶液的导电能力顺序:HCOOH > HCN > H2CO3
难度: 中等查看答案及解析
-
已知常温时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
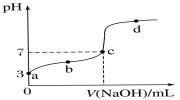
A.a点表示的溶液中c(H+)等于10-3 mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中
均等于K
难度: 困难查看答案及解析
-
常温下,向1L0.1mol·L-1 NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发,且始终维持常温),下列说法不正确的是
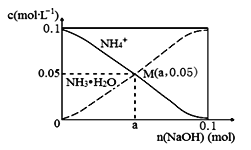
A.在M点时,n(OH-)-n(H+) = (a-0.05)mol
B.随着NaOH的加入,c(H+) / c(NH4+)不断增大
C.M点溶液中水的电离程度比原溶液小
D.当n(NaOH)=0.1mol时,c(OH-)>c(Cl-)-c(NH3•H2O)
难度: 中等查看答案及解析
-
亚磷酸(H3PO3)是二元弱酸,亚磷酸主要用作尼龙增白剂,电解Na2HPO3溶液也可得到亚磷酸,装置示意图如图(其中阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列说法不正确的是
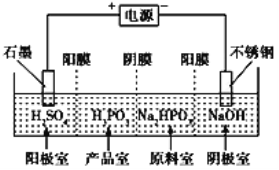
A. 阳极的电极反应式为2H2O-4e-= 4H++O2↑
B. 产品室中发生的离子反应为HPO32-+2H+=H3PO3
C. 原料室中Na+浓度保持不变
D. 阴极室中溶液的pH逐渐升高
难度: 困难查看答案及解析


 Cr(OH)3
Cr(OH)3 CrO2-,则阴极区溶液pH 的范围为_________。
CrO2-,则阴极区溶液pH 的范围为_________。 B.
B.  C.
C. 

