-
下列各组微粒中,在一定条件下均可以作氧化剂的是( )
A. Fe、H2O、CO2 B. Fe3+、MnO4—、NO3—
C. Cl2、HClO、Mg D. ClO-、Cl-、Ag+
难度: 中等查看答案及解析
-
某胶体遇盐卤(MgCl2)或石膏水发生凝聚,而遇食盐水或硫酸钠溶液不易发生凝聚,下列说法中错误的是( )
A. 胶体粒子直径在l~100 nm之间
B. 遇BaCl2溶液或氢氧化铁胶体可发生凝聚
C. 电泳时,该胶体向阴极方向移动
D. 钠离子使此胶体凝聚的效果不如Ca2+、Mg2+
难度: 简单查看答案及解析
-
实验室里需要240 mL 0.1 mol·L-1的硫酸铜溶液,现选取250 mL容量瓶进行配制,以下叙述正确的是( )
A. 称取4.0 g无水硫酸铜,加水250 mL
B. 称取6.25 g胆矾,加水250 mL
C. 称取3.84 g无水硫酸铜,配成250 mL溶液
D. 称取4.0 g无水硫酸铜,配成250 mL溶液
难度: 中等查看答案及解析
-
分类方法在化学学科的发展中起到了非常重要的作用,下列分类标准合理的是
A.根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
B.根据纯净物的元素组成,将纯净物分为单质和化合物
C.根据能否与碱反应将非金属氧化物分为酸性氧化物和不成盐氧化物
D.根据其溶液是否导电,将物质分为电解质和非电解质
难度: 简单查看答案及解析
-
已知浓盐酸和次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓) ===CaCl2+2Cl2↑+2H2O。用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是:
①CO2②HCl③H2O④O2
A.①②③ B.②③④ C.②③ D.①④
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 氧化还原反应的本质是元素化合价的升降
B. 氧化还原反应一定有氧元素参加
C. 氧化反应一定先于还原反应
D. 发生氧化反应的物质也可能同时发生还原反应
难度: 简单查看答案及解析
-
除去氧化铁中的二氧化硅,可采用的试剂是
A.盐酸 B.硝酸 C.蒸馏水 D.烧碱溶液
难度: 简单查看答案及解析
-
某无色透明溶液中,能大量共存的离子组是( )
A.Cu2+、Na+、SO42-、Cl﹣ B.Ba2+、Na+、OH﹣、SO42-
C.OH﹣、HCO3﹣、Ca2+、Na+ D.K+、Na+、OH﹣、NO3﹣
难度: 简单查看答案及解析
-
铅笔芯的主要成分是石墨。如果铅笔芯写一个字消耗的石墨质量约为1×10-3g,那么一个铅笔字含有的碳原子数约为
A. 5×1019个 B. 5×1022个 C. 2.5×1022个 D. 2.5×1019个
难度: 简单查看答案及解析
-
下列物质中均既有离子键又有共价键的一组是
A.NaOH、H2O、NH4Cl B.KOH、Na2O2、NH4Cl
C.MgO、CaBr2、NaCl D.Na2SO4、HCl、MgCl2
难度: 中等查看答案及解析
-
R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )
A.若R(OH)n为强碱,则W(OH)n+1也为强碱
B.若HnXOm为强酸,则Y是活泼非金属元素
C.若Y的最低化合价为-2,则Z的最高正化合价为+6
D.若X的最高正化合价为+5,则五种元素都是非金属元素
难度: 中等查看答案及解析
-
下列反应中关于“H2O”的说法错误的是( )
A.2F2+2H2O=4HF+O2反应中,水作还原剂,失电子
B.2Na+2H2O=2NaOH+H2↑反应中,水被氧化
C.CH4+2O2=CO2+2H2O反应中,H2O是还原产物
D.Na2O+H2O=2Na++2OH﹣反应中,水既不是氧化剂也不是还原剂
难度: 简单查看答案及解析
-
已知某两种物质在一定条件下能发生化学反应,其反应的微观示意图如图,则下列说法正确的是( )
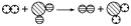
(说明:一种小球代表一种元素的原子)
A.图中的反应物都是化合物 B.该反应属于置换反应
C.该反应属于非氧化还原反应 D.该反应不符合质量守恒定律
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是( )
A.少量的碳酸氢钠溶液与澄清石灰水混合:2
+2OH-+Ca2+=CaCO3↓+
+2H2O
B.过量的碳酸氢钠溶液与澄清石灰水混合:
+OH-+Ca2+=CaCO3↓+H2O
C.碳酸氢钠溶液与少量的盐酸溶液混合:
+H+=CO2↑+H2O
D.碳酸钠溶液与过量的盐酸溶液混合:Na2CO3+2H+=2Na++CO2↑+H2O
难度: 简单查看答案及解析
-
已知氧元素的原子结构示意图为
。试根据以下各元素的原子结构示意图判断与氧元素化学性质最相似的是( )
A.F
B.S
C.Ne
D.Cl
难度: 简单查看答案及解析
-
标况下,H2O的质量为x g,含有y个氢原子,则阿伏加德罗常数为( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
加热5g碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了0.31g,则原混合物中碳酸钠的质量为
A.3.38g B.4.58g C.4.16g D.4.41g
难度: 简单查看答案及解析
-
用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。

一种生成Na2FeO4的反应如下:Fe2O3+Na2O2(氧为-1价)
Na2FeO4+Na2O(未配平),下列说法不正确的是( )
A.Na2O2既是氧化剂又是还原剂
B.Fe2O3在反应中失去电子
C.配平后为Fe2O3+3Na2O2=2Na2FeO4+Na2O
D.Na2FeO4能消毒杀菌是因其具有强氧化性
难度: 简单查看答案及解析
-
短周期元素A、B、C原子序数依大增大,A3-与B2-、C+电子层结构相同,则下列说法中不正确的是
A.三种元素可组成CAB2和CAB3型化合物
B.离子半径:C+>B2->A3-
C.H2B在同主族元素气态氢化物中最稳定
D.B的某种单质可用于杀菌消毒
难度: 中等查看答案及解析
-
现有下列几个离子反应:
①Cr2O72-+14H++6Cl-=2Cr3++3Cl2↑+7H2O
②2Fe2++Br2=2Fe3++2Br-
③2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
下列有关性质的比较中正确的是( )
A.氧化性:Cr2O72->Cl2>Fe3+ B.氧化性:Cl2>Br2> Cr2O72-
C.还原性:SO2<Fe2+<Br- D.还原性:Cl->Cr3+>Fe2+
难度: 简单查看答案及解析
-
下列分子中含有的电子数目与HF相同,且只有两个极性共价键的是( )
A.CO2 B.N2O C.H2O D.CH4
难度: 简单查看答案及解析
-
下列化学用语中,正确的是( )
A.溴化钠的电子式为Na:Br:
B.镁的原子结构示意图为
C.用电子式表示氯化氢分子的形成过程为H·+
D.重水的化学式为
(或D2O)
难度: 简单查看答案及解析
-
实现下列转化,必须加入氧化剂或还原剂的是( )
A.NO2→HNO3+NO B.
→NH3
C.NH3→NO D.P2O5→H3PO4
难度: 中等查看答案及解析
-
20 ℃时,饱和氯化钾溶液的密度为1.174 g/mL,物质的量浓度为4.0 mol/L,则下列说法中正确的是
A.25 ℃时,饱和氯化钾溶液的浓度小于4.0 mol/L
B.此溶液中氯化钾的质量分数为
×100%
C.20 ℃时,密度小于1.174 g/mL的氯化钾溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20 ℃时,溶液密度一定大于1.174 g/mL
难度: 中等查看答案及解析


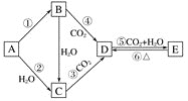
 b.
b.  d.
d.