-
室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色
X溶液中一定含有Fe2+
B
向浓度均为0.05 mol·L−1的NaI、NaCl混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成
Ksp(AgI)> Ksp(AgCl)
C
向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色
Br2的氧化性比I2的强
D
用pH试纸测得:CH3COONa溶液的pH约为
9,NaNO2溶液的pH约为8
HNO2电离出H+的能力比CH3COOH的强
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
下列关于物质的表述不正确的是( )
A.港珠澳大桥采用超高分子量聚乙烯纤维吊绳,其商品名为“力纶”是有机高分子化合物
B.3D打印钛合金材料用于航天航空尖端领域是利用了钛合金密度小强度大等特点
C.位于贵州省平塘县的中国天眼FAST使用的SiC是一种无机非金属材料
D.泰国银饰和土耳其彩瓷是“一带一路”沿线国家的特色产品,其主要成分均为金属材料
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是( )
A.1mol氨基(-NH2)含有9NA个电子
B.1mol2,2-二甲基丁烷中含有2NA个甲基
C.标准状况下,22.4LSO2完全反应时,转移2NA个电子
D.1mol乙酸乙酯在碱性条件下水解后,溶液中存在NA个CH3COO-
难度: 简单查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期主族元素。Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子总数与X、W原子的电子总数之比为5:4。下列说法正确的是( )
A.原子半径:W>Z>Y>X
B.Y的简单气态氢化物的热稳定性比Z的强
C.由X、Z组成的化合物与由Z、W组成的化合物只能发生化合反应
D.由X、Y、Z三种元素组成的化合物可以是酸、碱或盐
难度: 中等查看答案及解析
-
环与环之间共用两个或多个碳原子的多环烷烃称为桥环烷烃,其中二环[1.1.0]丁烷 (
)是其中一种。下列关于该化合物的说法正确的是
A.与C3H4是同系物
B.一氯代物只有一种
C.与环丁烯互为同分异构体
D.所有碳原子可能都处于同一平面
难度: 中等查看答案及解析
-
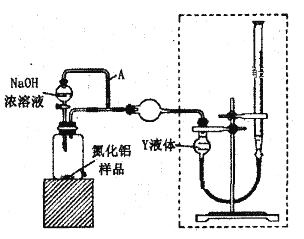
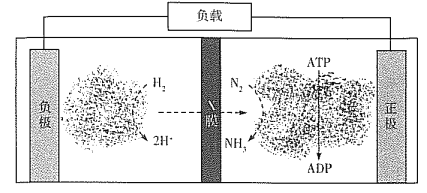
人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2]。下列有关说法正确的是( )
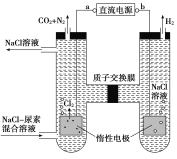
A. a为电源的负极
B. 电解结束后,阴极室溶液的pH与电解前相比将升高
C. 除去尿素的反应为:CO(NH2)2+2Cl2+H2O== N2+CO2+4HCl
D. 若两极共收集到气体0.6mol,则除去的尿素为0.12mol(忽略气体溶解,假设氯气全部参与反应)
难度: 中等查看答案及解析
-
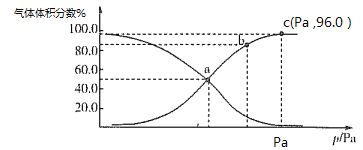
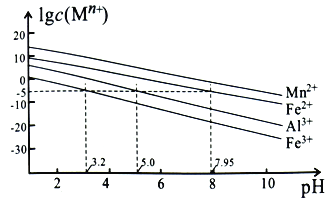
已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7;p(Ni)=-lgc(Ni2+),p(B)=-lgc(S2-)或-lgc(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是( )
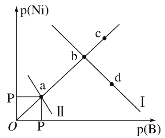
A.常温下NiCO3的溶解度大于NiS的溶解度
B.向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
C.对于曲线Ⅰ,在b点加热,b点向c点移动
D.P为3.5且对应的阴离子是CO32-
难度: 困难查看答案及解析
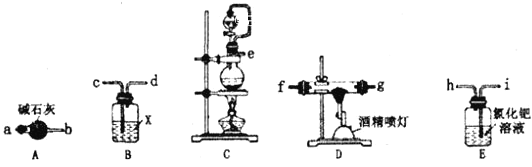
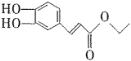 )在自身免疫性疾病的治疗中有着重要的应用,工业上以乙烯和芳香族化合物B为基本原料制备F的路线图如下:
)在自身免疫性疾病的治疗中有着重要的应用,工业上以乙烯和芳香族化合物B为基本原料制备F的路线图如下: